Введение
Лекарственная аллергия представляет собой необычайную сложность для врачей любой специальности, что обусловлено как самой структурой лекарственных аллергенов, так и разнообразием вариантов иммунного ответа на лекарства.
Как известно, побочные действия на лекарства можно подразделить на 2 типа. Реакции типа А обычно предсказуемы и напоминают фармакологическое действие лекарства, реакции типа Б непредсказуемы и включают как идиосинкразию, обусловленную индивидуальной предрасположенностью организма (некие дефекты ферментной системы), так и реакции гиперчувствительности, т. е. аллергию. Когда подозреваются аллергические реакции на лекарства, термин «реакции лекарственной гиперчувствительности» (РЛГ) является предпочтительным [1]. Таким образом, лекарственная аллергия представляет собой РЛГ, в основе которых лежит иммунный механизм.
Аллергические реакции составляют 6–10% в структуре всех побочных действий лекарственных средств. По данным ФГБУ «ГНЦ Институт иммунологии» ФМБА России, лекарственная аллергия составляет 5% среди амбулаторных больных, при этом у 43% из них — реакция на местные анестетики (МА) [2].
Существующие представления о высокой аллергенности МА зачастую связаны с тем, что РЛГ отождествляют с другими многообразными побочными действиями МА: ваго-вагальными синкопе, психомоторными реакциями, токсическим действием на центральную нервную и сердечно-сосудистую системы, которые могут быть связаны со случайным попаданием МА в кровеносный сосуд и прямым влиянием последних на натриевые каналы нервных волокон и кардиомиоцитов. МА могут угнетать различные рецепторы, усиливая выброс глютамата, и подавлять деятельность внутриклеточных сигнальных путей [3].
Токсичность МА может быть обусловлена различными консервантами: парабенами (эфиры парагидроксибензойной кислоты), солями ЭДТА и сульфитами [4].
Некоторые лекарственные препараты (мочегонные, сульфаниламиды, пероральные противодиабетические) являются производными парааминобензойной кислоты, поэтому использование МА, содержащих парабены, противопоказано ввиду возможной перекрестной аллергии. Для увеличения длительности анестезии во многие МА входит адреналин, обратной стороной медали чего являются тахикардия, общая слабость, головокружение, учащенное дыхание, артериальная гипертензия, связанные с токсичностью адреналина [5].
Классификация МА основана на длительности их действия и фармакологических свойствах [6]. По химическим свойствам МА классифицируются на: аминоэфиры (новокаин, прокаин, тетракаин), аминоамиды (лидокаин, мепивакаин, прилокаин, бупивакаин, левобупивакаин, ропивакаин). Доказано, что МА эфирной группы более аллергенны, чем амидной, в связи cо способностью образовывать метаболит типа парааминобензойной кислоты. В случае возникшей реакции на МА необходимо ответить на три вопроса: 1) является ли эта реакция аллергической; 2) каков механизм аллергической реакции; 3) какой препарат является клинически значимым?
Тщательно собирают аллергологический (наследственная отягощенность, наличие атопических заболеваний в прошлом и настоящем, спектр сенсибилизации) и фармакологический анамнез, уточняя: на какой препарат развилась реакция; какие препараты принимались перед непосредственным развитием реакции; через какой промежуток времени после введения МА развилась реакция; каков путь введения препарата; в какой дозе применялся препарат; каковы клинические проявления реакции; чем купировалась реакция; были ли ранее реакции на лекарства; принимал ли пациент после развития реакции препараты из этой группы или перекрестно реагирующие; какие препараты применяет и переносит хорошо. Усугублять течение реакции может сопутствующая патология и физиологическое состояние (беременность, детский и старческий возраст). Физикальное обследование проводят по общепринятым правилам [7].
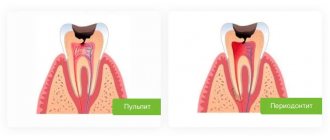
Аллергия на МА может протекать как с преимущественным поражением отдельных органов, так и с системными проявлениями. Аллергические реакции могут развиваться по любому из типов согласно классификации Джелла и Кумбса, а также классификации лекарственной аллергии, принятой Международным консенсусом по лекарственной аллергии [1]. Для МА характерно развитие аллергических реакций по немедленному, I типу (иммуноглобулин Е (IgE) -зависимый: ангиоотек, крапивница, бронхоспазм) и замедленному, IV типу (аллергический контактный дерматит, различные экзантемы) [8].
Существуют два метода аллергодиагностики: пробы in vivo
и
in vitro
.
Тесты in vivo
Для подтверждения аллергических реакций на МА используют кожные тесты (прик-тест, внутрикожный, аппликационный) и дозируемый провокационный тест (осторожное повторное введение подозреваемого препарата). В случае лекарственной аллергии на МА проведение всех тестов in vivo
возможно по строгим показаниям. Кожные тесты рекомендуется проводить через 4–6 нед. после перенесенной реакции, в период ремиссии, после отмены лекарственных препаратов. Информативность кожного тестирования зависит от многих причин (может развиться реакция не на сам препарат, а на его метаболит; следует принимать во внимание как дермографизм, так и ареактивность кожи). Эти тесты просты в исполнении, наиболее экономичны по затратам, но опасны ввиду возможного развития анафилактических реакций [9]. В настоящее время нет доступных сертифицированных реагентов для кожных проб при аллергии на МА. Обычно на практике для проведения кожных тестов используются стандартные концентрации МА, которые готовятся непосредственно перед тестированием [10]. В нашей работе при обследовании 147 пациентов, имеющих анамнестические указания на непереносимость МА, положительные кожные пробы (прик-тесты) выявлены у 8 пациентов (5,4%): у 5 — на артикаин + эпинефрин, у 2 — на лидокаин, у 1 — на мепивакаин. При постановке кожных тестов отмечено развитие симптомов крапивницы и бронхоспазма средней степени тяжести у 1 пациента на введение комбинированного препарата, содержащего артикаин + эпинефрин.
Для диагностики аллергии на МА также используют тест торможения естественной эмиграции лейкоцитов in vivo
, предложенный академиком А.Д. Адо [11].Достоинство метода заключается в исследовании аллергической реакции
in situ
. Впоследствии мы применили этот принцип при разработке микропровокационных тестов с МА с определением в слюне триптазы, эозинофильного катионного белка и миелопероксидазы [12]. Исследовали указанные медиаторы в слюне до и после провокации стандартными методами с применением иммунохемилюминесцентного и иммуноферментного анализа (ИФА). Это позволило дифференцировать различные варианты иммунного ответа на МА малоинвазивным способом. В целом все пробы
in vivo
опасны и могут применяться в неизбежных случаях [13].
Клинический анализ крови.
Диагностически значимым является повышение эозинофилов крови свыше 5%. Однако в случае непереносимости МА эозинофилия встречается крайне редко, и чаще это сочетается с сопутствующей атопической конституцией и аллергией на неинфекционные аллергены (ингаляционные, пищевые). Некоторые врачи пытаются соотнести повышение количества лейкоцитов периферической крови с аллергическими реакциями на лекарственное средство, но подобное повышение может быть вызвано другими причинами [14].
Тесты in vitro
Выбор теста зависит от предполагаемого механизма и времени с момента развития аллергической реакции [15]. Лабораторная диагностика лекарственной аллергии включает в себя диагностические и прогностические методы. Позиционный документ Европейской академии аллергологии и клинической иммунологии рассматривает наиболее приемлемые диагностические тесты при аллергических реакциях на лекарства [16]. Среди диагностических тестов in vitro
при аллергических реакциях немедленного типа в острую фазу предпочтение отдается определению триптазы и гистамина, при реакциях в отдаленном периоде — различным методам определения специфического IgЕ и тесту активации базофилов (basophil activation test — BAT), выполненному методом проточной цитометрии. Для подтверждения РЛГ замедленного типа рекомендуют следующие лабораторные методы: тест трансформации лимфоцитов; определение интерлейкинов ИЛ-5, ИЛ-2, ИЛ-4 или гранзима методами ИФА, ELISpot (Enzyme-Linked ImmunoSpot), мультиплексного анализа, комбинацией определения цитокинов и маркеров цитотоксичности. К прогностическим методам относят определение HLA-маркеров.
Определение триптазы
тучных клеток подтверждает их дегрануляцию. Уровень триптазы может повышаться в течение 24 ч после развития острой аллергической реакции (чаще всего в течение 30–120 мин). Тест высокочувствительный, но неспецифический [17].
Тест высвобождения гистамина
выявляет высвобождение гистамина в ответ на стимуляцию аллергеном. Однако уровень гистамина быстро (в течение получаса) снижется после развития аллергической реакции, поэтому этот тест используется только в исследовательских целях.
Определение метилгистамина
в моче. N-метилгистамин является стабильным метаболитом гистамина и определяется в моче. Он является индикатором дегрануляции тучных клеток при острой аллергической реакции. Для интерпретации результатов важно провести оценку функции почек. Однако разрешение на клиническое использование данного теста недавно было отозвано [18].
Определение анафилатоксинов
(C3a, C4a, C5a) проводят при подозрении на острые аллергические реакции, они служат маркерами активации системы комплемента. Их исследование имеет особую ценность в ситуациях, когда воспалительный процесс протекает без участия IgE-антител. Однако данный метод редко используется в рутинной практике.
Лабораторная диагностика IgЕ-зависимых состояний
Определение специфических IgE
in vitro
является одним из самых распространенных методов диагностики аллергических реакций немедленного типа [19]. Для количественного определения аллерген-специфических антител используют разнообразные методы, в основе которых лежит следующее условие: аллерген, ковалентно связанный с твердыми частицами, инкубируют с сывороткой больного, предположительно содержащей специфические IgE против исследуемого аллергена. Находящиеся в сыворотке антитела связываются с аллергеном, фиксируясь на частицах твердой фазы. Добавление вторых анти-IgE, меченных различными метками (радиоиммунной, ферментной, флуоресцентной), позволяет количественно оценить содержание аллерген-специфических антител. К достоинствам метода относится использование сыворотки, которую можно замораживать и легко транспортировать. Ограничением является временной интервал. Этот метод может использоваться через 4–8 недели после перенесенной реакции у пациентов с высоким риском анафилаксии [20], интенсивность реакций снижается в течение года. Метод может давать ложноположительные результаты при высоком уровне общего IgЕ, но преимуществом является факт выявления сенсибилизации при положительном анамнезе и отрицательных кожных тестах. Доказана высокая чувствительность этого метода для бета-лактамных антибиотиков (38–80%) и нейромышечных релаксантов (61–92%) [15].
Авторами проводилось исследование специфических IgE к МА методом ИФА с применением тест-систем Doctor FOOKE. Обследовано 280 пациентов с подозрением на аллергию на МА (сомнительные анамнез и результаты кожных тестов). Положительные тесты выявлены на: ультракаин — 4,2%, бензокаин — 3, 8%, тетракаин — 2,9%, артикаин — 2,4%, мепивакаин — 1,9%, бупивакаин — 1,7%, прилокаин — 1,3%, лидокаин — 4,2% случаев [21, 22].
Авторами применялся вариант Capture-ИФА у 147 пациентов с использованием реагентов . В результате выявлены положительные тесты на: ультракаин — 3,9%, мепивакаин — 2,1%, лидокаин — 3,8% случаев. Тесты выявили значимую корреляцию с клинической картиной (r>0,5). Учитывая возможность развития аллергических реакций на эпинефрин, было проведено исследование специфических IgE на лидокаин, мепивакаин, ультракаин с одновременным определением антител к эпинефрину реагентами . В 11,8% случаев выявлены положительные тесты на эпинефрин. Среди обследованных у 17 человек (11,6%) были отмечены отрицательные антитела к МА, у 2 выявлен положительный тест на эпинефрин. При этом у этих двух пациентов в анамнезе имелись указания на развитие ангиоотека и респираторных симптомов (в т. ч. удушье) при применении комбинированного препарата артикаин + эпинефрин. Таким образом, сделан вывод о том, что истинные IgE-реакции на МА развиваются достаточно редко, но поскольку эти реакции могут носить жизнеугрожающий характер, то исследования, в т. ч. in vitro
, по установлению причинного этиофактора целесообразно проводить.
Следует отметить проводимую работу в направлении разработки АллергоФлоу — первого отечественного теста для определения уровня активации базофилов методом проточной цитометрии. Поскольку данный метод может быть чрезвычайно полезен при диагностике гиперчувствительности немедленного типа, сложных случаев IgE-зависимой лекарственной аллергии и определении латентной сенсибилизации, фирмой активно ведется работа по расширению ассортимента аллергенов, в т. ч. аллергенов на различные МА, для совместного использования с тест-системой АллергоФлоу.
Исследование IgG
не относится к собственно диагностическим тестам и проводится, как правило, в комплексе с определением IgE. По данным литературы, роль IgG к аллергенам до конца не ясна. Полагают, что имеется по крайней мере два функционально различающихся вида IgG4-антител, к одному из которых относятся блокирующиеся антитела, а к другому — анафилактические. Существуют исследования, в которых не доказана связь между наличием в сыворотке крови специфических IgG и IgG4 к аллергену и клиническими проявлениями атопии. Однако известно, что IgG характеризуют частоту контактов с аллергеном.
Авторами исследованы IgG к МА. В результате у пациентов с непереносимостью МА выявлены IgG на: артикаин — 2,4%, мепивакаин — 1,84%, прилокаин — 1%, лидокаин — 4% случаев. Полученный опыт [23, 24] позволяет авторам заключить, что определение IgG при аллергии на МА является вспомогательным инструментом диагностики и должно интерпретироваться совместно с определением IgE. Когда результаты определения IgG совпадают с результатами определения IgE, то с высокой долей вероятности мы полагаем, что это аллергическая реакция. По большей части положительные результаты коррелируют с предшествующими контактами с лекарственным аллергеном [25].
Тест активации базофилов (BAT)
В последние десятилетия BAT является классическим методом диагностики аллергии. Базофилы и мастоциты играют центральную роль в аллергических реакциях немедленного типа. D.G. Ebo [18] указывает на возрастающий интерес исследователей к BAT, при котором активация указанных клеток измеряется методом проточной цитометрии. В настоящее время наиболее часто используются такие маркеры активации базофилов, как CD63 и CD203c. Flow-CAST и CAST-ELISA — это коммерческие анализы, основанные на активации базофилов. CAST-ELISA определяет выделение сульфодилейкотриенов, активированных базофилами, методом ИФА. Анализ выполняется крайне медленно и занимает много рабочего времени, его применение нецелесообразно в условиях загруженности лабораторной службы.
Flow-CAST использует проточную цитометрию для идентификации базофилов, меченных анти-IgE-флуоресцеин-изотиоцианатом и анти-CD63-PE — маркерами активации и дегрануляции. Модификация Flow-CAST c использованием анти-CD203c вместо анти-CD63 улучшает характеристики исследования [25].
Сообщается, что чувствительность и специфичность BAT при аллергии на миорелаксанты варьирует от 36% до 92% и от 93% до 100% соответственно [26], а при аллергии к бета-лактамным антибиотикам чувствительность колеблется от 33% до 67%, а специфичность — от 79% до 100% [27]. Можно считать метод BAT весьма перспективным для оценки как аллергических реакций немедленного типа, так и неаллергической гиперчувствительности [28]. Имеется ограниченный опыт использования метода BAT при лекарственной аллергии на МА. Так, Н.В. Бычковой исследованы реакции 189 человек (средний возраст 37 лет) на МА группы артикаина, лидокаина, мепивакаина (разведение 1:30). Реже всего сенсибилизация выявлена у пациентов на препараты группы лидокаина (8%) и мепивакаина (3%). Среди препаратов группы артикаина частота положительных реакций у пациентов варьировала от 41% до 18% в зависимости от состава препарата. Автор заключает, что использование лидокаина, мепивакаина и артикаина, в которых нет консервантов, является предпочтительным для пациентов [29].
Симптомы аллергии в стоматологии
При лекарственной форме реакция может проявиться в виде поражения кожных покровов, крапивницы.
Контактная форма предполагает отек слизистой, зуд, жжение, возникновение аллергического стоматита.
Одним из самых тяжелых проявлений аллергии в стоматологии является анафилактический шок. Первыми признаками начинающейся реакции становятся покалывание кожи лица, затем слабость во всем теле, боль в груди. Если в этот момент ничего не предпринять, может начаться отек дыхательных путей, сердечная недостаточность, судороги. Исход подобного бездействия способен оказаться фатальным.
Тесты для диагностики аллергических реакций замедленного типа на местные анестетики
Для диагностики аллергических реакций замедленного типа на МА рекомендуются тесты: трансформации лимфоцитов (ТТЛ); торможения миграции макрофагов; идентификации клеточных мембран; цитотоксичности лимфоцитов; микросомальной продукции антител [15].
ТТЛ основан на анализе пролиферации Т-лимфоцитов в присутствии причинно-значимого лекарственного аллергена. В зависимости от препарата чувствительность этого теста составляет 60–70%, специфичность — 85–93% [30].
Клиническая картина также определяет чувствительность теста: при легких и среднетяжелых формах аллергических проявлений чувствительность выше (58–89%) [31], чем при тяжелых буллезных дерматитах (25–75%) [32]. К недостаткам можно отнести длительность проведения теста (5–7 дней), необходимость дорогостоящего оборудования и хорошо обученного персонала, опасность радиоактивного заражения. В настоящее время радиоактивные метки чаще заменяют флуорохромами. Однако имеются лишь единичные указания на использование метода ТТЛ для диагностики аллергии на МA [33]. Все чаще как альтернатива ТТЛ применяются другие, менее трудоемкие и менее опасные методы определения маркеров активации Т-клеток, хотя ТТЛ до сих пор является «золотым стандартом».
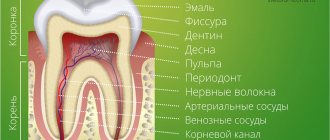
Как проявляется аллергия на протезы
Подытожим. Какие симптомы после процедуры протезирования должны подтолкнуть человека задуматься об осложнении — аллергии на зубные протезы и самостоятельно обратится к лечащему врачу в стоматологическую клинику:
- жжение во рту
- покраснение десен
- повышенная температура
- кровоточивость десен
- сыпь в ротовой полости и вокруг
- отечность мягких тканей (щеки, десны, язык)
- отек губ, век
- металлический привкус
- пощипывание
- боль при жевании
- повышенное слюноотделение
- кашель как при бронхиальной астме
- отек Квинке
Измерение активационных маркеров и цитокинов
После антигенной стимуляции на Т-клетках экспрессируются активационные маркеры, такие как CD25, CD69, CD40L, CD71, HLA-Dr, которые можно измерять методами проточной цитометрии или иммунофлуоресценции с использованием специфических моноклональных антител. Имеются немногочисленные работы, в которых упоминается их использование при аллергии на лекарства [34, 35].
Так как замедленные реакции на лекарства характеризуются появлением сенсибилизированных Т-лимфоцитов, для определения иммунного ответа могут применяться и другие методы:
измерение уровня лимфоцитов, экспрессирующих хемокиновые рецепторы (CCR4, CCR7, CCR10) — проводится методом проточной цитометрии и иммуногистохимии. Рядом авторов показана их роль в Т-клеточном воспалении кожи [36];
определение цитокинов ИЛ-2, ИЛ-5, ИЛ-13, интерферона-гамма методами проточной цитометрии и методом ИФА. Авторы показали высокую диагностическую значимость этих методов (75% и 79% соответственно) [37, 38]. Цитокины можно определять и в супернатантах методом ELISpot, который напоминает ИФА;
определение цитотоксичности Т-лимфоцитов и натуральных киллеров. Определяют цитотоксичные протеазы (гранзим В и гранулизин). Используют методы иммуногистохимии и ELISpot. Доказана низкая чувствительность у пациентов с DRESS-синдромом, но более высокая чувствительность — с синдромом Стивенса — Джонсона и токсикоэпидермальным некролизом [39]. Некоторые авторы предлагают определение кожного лимфоцит-ассоциированного антигена методом цитофлоуметрии [40];
определение транскрипционных белков (c-maf, GATA3, T-bet, STATs, p38MARK методами полимеразной цепной реакции и проточной цитометрии [41].
В настоящее время прогностическими методами можно считать только генетические маркеры, как, например, показано для некоторых этнических групп в отношении определенных препаратов (абакавир, карбамазепин, дапсон и аллопуринол) [42, 43]. Однако генетических корреляций с аллергией на МА пока не выявлено.
Таким образом, большинство описанных методов лабораторной диагностики лекарственной аллергии на МА, за исключением определения специфических IgЕ и IgG и BAT, пока доступны только исследовательским лабораториям.
Вопросы и ответы
Записан на имплантацию на Пролетарской имплантов BOI с системами KOS и BCS — какие лекарства будут применять?
Добрый день. Я записан на имплантацию на Пролетарской имплантов BOI с системами KOS и BCS. Для проведения операции мне нужно пройти аллергодиагностику. Какие лекарства для анестезии мне будут использовать, чтобы правильно определить возможные аллергены?
Здравствуйте! При проведении имплантации зубов в наших клиниках используются анестезирующие средства Убистезин и Ультракаин. Если вам потребуется дополнительная информация рекомендуем проконсультироваться с вашим лечащим врачом. С уважением, Центр поддержки пациентов SIMPLADENT + + 8-800-333-53-41
Другие вопросы