1620
Барьерные мембраны – это современный хирургический тонколистовой материал, предназначенный для изоляции операционных ран, заполненных костным заменителем при направленной остеорегенерации.
Мембраны применяются для повышения эффективности костной регенерации, ускорения заживления ран, исключения резорбции костной ткани и послеоперационных осложнений.
Барьерные пленки используются в стоматологической хирургии при различных видах костной пластики, лоскутных операциях на пародонте, хирургической коррекции челюстно-зубных аномалий и пр.
Общее представление
Американская компания Osteogenics Biomedical производит различные по характеристикам барьерные мембраны из натуральных и искусственных материалов.
Резорбируемые материалы производятся из натурального сырья – сухожилий крупного рогатого скота и свиного коллагена.
Исходным материалом нерезорбируемых мембран является политетрафторэтилен. Материал из PTFE может иметь нетекстурированную и текстурированную поверхность, быть модифицирован (упрочнен) титаном.
Барьерные мембраны компании Osteogenics Biomedical
| Резорбируемые | Разм., мм | Нерезорбируемые | |||||
| Нетекстурированные | Разм., мм | Микротекстурированные | Разм., мм | Усиленные титаном | Разм., мм | ||
| Cytoplast RTM Collagen | 30х40, 20х30,15х20. | Cytoplast GBR-200 Singles | 12х24 | Cytoplast TXT-200 Singles | 12х24 | Cytoplast TI-250 ANTERIOR | 14х24, 12х24 |
| Cytoplast GBR-200 | 25х30 | Cytoplast TXT-200 | 25х30 | Cytoplast TI-250 BUCCAL | 17х25 | ||
| Cytoplast TI-250 POSTERIOR | 25х30, 20х25 | ||||||
| Cytoplast TI-250 XL | 30х40 | ||||||
Нерезорбируемая дентальная мембрана из политетрафторэтилена (PTFE) – является эксклюзивным продуктом, не производимым больше никем, кроме Osteogenics Biomedical.
Материал предназначен для направленной регенерации костной и десневой ткани при хирургических операциях в стоматологии.
В числе основных назначений Cytoplast GBR-200:
- обеспечение первичного покрытия раны;
- недопущение резорбции кости;
- стимулирование роста костной ткани из остеозаменителя;
- защита раны от болезнетворных микроорганизмов;
- ускорение заживления раны;
- упрощение работы хирургов.
Коррекция аномалий прикуса с помощью микроимплантов Vector Tas и особенности их использования.
Заходите сюда, если интересуют характеристики и назначение костного материала Bio Oss.
По этому адресу https://www.vash-dentist.ru/implantatsiya/metodiki/temperaturyi-posle-zubov.html узнайте, сколько держится температура после имплантации зубов при положительном исходе операции, и какие показатели указывают на необходимость обращения к врачу.
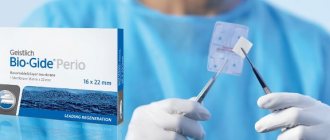
Резорбируемые коллагеновые мембраны
Стоматологические мембраны «Био Вин» (15х20/20×30/30х40) имеют хорошую биосовместимость, сделаны из свиного коллагена I и III типов. Можно вырезать необходимые формы, являются гибкими и безупречно адаптируются к дефектам.
Дентальные мембраны «РТМ Коллаген» (15х20/20×30/30х40) имеют хорошую эластичность, сделаны из бычьего сухожилия с I типов степени очистки. Многослойная конструкция мембраны и уникальное строение волокон обеспечивает высокую прочность.
| Название | Артикул | Цена |
| RTM Collagen 15х20мм — резорбируемая мембрана | RTM 1520 | 143 $ |
| RTM Collagen 20х30мм — резорбируемая мембрана | RTM 2030 | 182 $ |
| RTM Collagen 30х40мм — резорбируемая мембрана | RTM 3040 | 259 $ |
Основные характеристики
Материал Cytoplast Regentex GBR 200 представляет собой плотную полимерную пленку толщиной 0,2 мм с гладкой поверхностью.
Последняя особенность является значительным преимуществом в сравнении с традиционными резорбируемыми мембранами, поверхность которых способствует ретенции и инвазии бактериями, вызывающими отторжение покрывного материала и воспаление раны.
Гладкая поверхность GBR-200 «отталкивает» патогенные микроорганизмы, не допуская инфицирования и воспаления операционной зоны.
Мембрана Cytoplast Regentex обладает микропористой структурой с размером пор до 1,26 мкр, которые не пропускают через пленку бактерий, но в то же время являются проницаемыми для протеинов.
Пластично-эластичная консистенция материала позволяет растягивать и деформировать его, предавая нужную форму для адаптации к операционной зоне.
Цитопласт обладает самоприклеивающим свойством к раневой поверхности. В качестве дополнительной меры фиксации может применяться ушивание краев лоскута, уложенного поверх Cytoplast, легкими без натяжения швами, не затрагивающими самой мембраны.
Материал поставляется со стандартными размерами 12х24 мм и 25х30 мм. Из этих заготовок можно вырезать ножницами куски любых размеров, необходимых в конкретной клинической ситуации.
Как приживаются мембраны при имплантации зубов
Коллагеновые мембранные накладки снижают риск развития осложнений на фоне убывания мягких тканей. Неподшиваемые — за счет заживления мягких тканей путем вторичного натяжения раны защищают от общего воспалительного процесса. Оба вида хорошо интегрируются в ткани челюсти. Кость под поверхностью барьерной пластины восстанавливается по типу роста костной ткани эмбриона.
При использовании рассасывающихся накладок послеоперационная рана заживает без применения дополнительных медицинских препаратов. Нередко процесс заживления нерезорбируемых мембран сопровождается осложнениями, в частности, оголением конструкции. Это может привести к инфицированию и воспалению, из-за чего ее придется извлечь раньше срока.
Часто под барьерами создается благоприятный фон для развития микробов, поэтому не всегда удается добиться желаемого результата.
Состав и свойства
Мембрана GBR-200 состоит из одного PTFE (политетрафторэтилена (тефлона)) – фтористоуглеродного соединения, устойчивого к воздействию практически любых агрессивных химических агентов.
В условиях человеческого тела PTFE абсолютно не растворяется веществами и физиологическими жидкостями.
Физико-химические и биологические свойства:
- химическая стабильность;
- предельно низкая аллергенность;
- самоприклеиваемость к ране;
- газо- и светонепроницаемость;
- непроницаемость для бактерий;
- проницаемость для протеинов.
Преимущества и недостатки
Cytoplast обладает целым рядом клинических и технологических преимуществ в сравнении с традиционными шовными материалами, благодаря чему пользуется большой популярностью у хирургов-стоматологов.
Преимущественные характеристики
- Отсутствие необходимости первичного лоскутного закрытия раневого фрагмента (не нужно готовить и натягивать лоскутный материал).
- Непрорастание эпителия, благодаря высоким барьерным свойствам материала.
- Эластичность (мембрана растягивается в любом направлении, адаптируясь к ране).
- Стабильность структуры (не набухает).
- Отсутствие необходимости закрывать мембрану чем-либо сверху, пленка может оставаться полностью обнаженной. Для полного закрытия раневого участка достаточно одного Cytoplast GBR-200.
- Самоприклеиваемость к ране, благодаря особой микроструктуре. Не требуется применения сложных фиксирующих элементов для крепления пленки к кости, края раны можно не ушивать.
- Отсутствие каких-либо негативных последствий и химических реакций при контакте материала с внутриротовой жидкостью.
- Быстрое заживление раны.
- Сохранение формы наращиваемой костной ткани альвеолярного отростка.
- Легкое безоперационное извлечение мембраны из раны через 21-25 дней. Удаление производится через небольшое отверстие с помощью зонда.
- Полное отсутствие каких-либо осложнений.
Недостатки
Многочисленные испытания не выявили ни одного существенного недостатка, которые нередко наблюдаются при использовании мембран другого типа.
Не было отмечено отторжения, воспаления, пролиферации и иных тканевых реакций, негативно сказывающихся на процессе заживления.
К единственному недостатку можно отнести необходимость для хирурга-стоматолога иметь практический навык использования материала, для чего приходится пройти предварительное обучение.
Разновидности, используемые биоматериалы
Метод направленной тканевой регенерации в хирургической стоматологии основан на применении двух основных групп мембран: резорбируемых (коллагеновые, викриловые, из полимолочной кислоты и так далее) и нерезорбируемых (Gore-tex или сетчатые титановые, с титановым усилением, тефлоновые и другие).
Резорбируемые
Установка рассасывающихся мембран исключает их извлечение после приживления остеопластического материала. Такие накладки не всегда сохраняют стабильность на протяжении длительного периода. Для усиления пролонгированного действия их состав дополняют медленно резорбирующими веществами. Одним из главных преимуществ мембранных накладок является возможность обогащения их структуры препаратами, усиливающими остеогенез, противовоспалительными, противомикробными средствами и т.д.
Виды резорбируемых мембран:
- Синтетические полимеры (полиактиды, полигликолиды) и их химические модификации (например, Guidor, EpiGuide, Vicryl) — распад на микроскопические фрагменты, которые подвергаются фагоцитозу, происходит под действием гидролиза. Из недостатков изделий отмечают слабую тканевую интеграцию, высокую вероятность развития отечности во время резорбции из-за изменения рН в тканях. Преимущества полимерных пластин:
- отсутствие риска передачи инфекционного заболевания;
- гипоаллергенность;
- длительное действие (5-6 месяцев).
Нерезорбируемые
Способствуют эффективному восстановлению кости в заданном объеме и траектории, бывают:
- Бескаркасные — для восстановления костной ткани менее 4 мм.
- С титановым каркасом — для восстановления кости в больших объемах, во всех направлениях.
Главные преимущества:
- высокая механическая прочность;
- выраженные барьерные свойства.
Такие типы накладок должны извлекаться спустя 6-9 месяцев. Состоят из титана, эффективны в ситуациях, когда на кость приходится большая нагрузка, и нужно защитить импланты или костнопластический материал. Самым распространенным показанием для применения является вертикальная аугментация гребня. Удаляются после восстановления поврежденных в ходе операции мягких и костных тканей.
Основные недостатки:
- риск оголения — во время ушивания лоскута вставка должна быть полностью закрыта;
- отсутствие под накладкой процесса формирования надкостницы;
- пациенту необходимо часто посещать стоматолога (каждые 2 недели).
Статистика показывает, что наиболее эффективны мембраны из политетрафторэтилена (ПТФЭ) марки GoreTex и алифатического полиэфируретана (Вone-up). Реже используются сетчатой формы из сульфата кальция (Capset) или титана (Frios, BoneShield, Tiomesh).
Показания
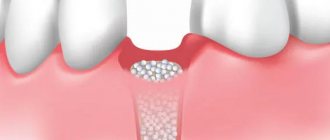
Мембрана GBR-200 рекомендуется к применению в стоматологии во всех случаях, связанных с направленной регенерацией кости:
- После удаления зубов для восстановления костной ткани альвеолярного отростка.
- Перед установкой имплантата при малом объеме кости.
- Во время или после установки имплантата – для закрытия раны.
- При аугментации в самых различных клинических случаях.
- При периимплантите (воспалении прилежащих к имплантату костных и мягких тканей, их резорбции и потере имплантата).
- При лоскутных операциях в ротовой полости, пластике и рецессии десны.
- При восстановлении челюстных пропорций (например, при плоскостной остеотомии, сопровождающейся подсадкой костной ткани между разъединенными фрагментами челюстных костей).
- При синус-лифтинге (Цитопласт укладывается на дно гайморовой пазухи для исключения риска проникновения остеозаменителя в синус через перфорации в слизистой оболочке).
Обсудим вместе плюсы и минусы имплантации зубов в сравнении с другими методиками протезирования.
В этой публикации мы расскажем, нужно ли пить антибиотики после имплантации зуба и зачем.
Пройдите по ссылке https://www.vash-dentist.ru/implantatsiya/metodiki/rashozhdeniya-shvov-posle-zubov.html, чтобы выяснить, когда снимают швы после имплантации зубов.
Что такое барьерные мембраны?
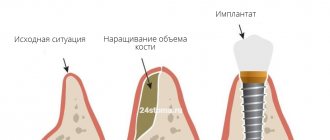
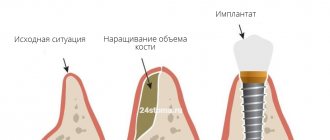
Барьерная мембрана — одно из самых современных и успешных изобретений в стоматологической практике. Такие конструкции активно используются практически во всех оперативных вмешательствах. Барьерные мембраны для костной пластики при имплантации позволяют предотвратить атрофические явления в альвеолярном отростке и способствуют одномоментной успешной фиксации искусственных корней. Мембрана влияет на регенераторные способности кости, увеличивая их, не пропускает внутрь опасные для костных клеток остеокласты и минимизирует риск проникновения патогенных агентов. Благодаря барьерной мембране приживление трансплантата ускоряется, как и общее лечение пациента.
Мембрана для костной пластики представляет собой очень тонкую и достаточно эластичную пластинку, которая крепится к кости титановыми штифтами. Таким образом происходит отделение десны от костного материала в процессе формирования натуральной ткани челюсти.
Виды мембран
Существует два типа барьерных мембран, которые широко используются в стоматологии:
- Резорбируемые. Такая конструкция постепенно рассасывается. Она не требует отдельного удаления, то есть дополнительного оперативного вмешательства, а значит приносит меньший травматизм.
- Нерезорбируемые. Мембраны такого типа самостоятельно не рассасываются, из-за чего пациенты нуждаются в дополнительном этапе лечения — удалении конструкции. В большинстве случаев они изготавливаются из титана. Крепятся такие мембраны при наличии серьезного дефицита костной ткани, восполненного гранулами остеогенного материала. После того, как альвеолярный отросток и мягкие ткани десны восстановятся, барьерная мембрана удаляется.
Стоматолог самостоятельно подбирает оптимальную мембрану для конкретного клинического случая. Он должен учитывать, что резорбируемые конструкции недостаточно хорошо фиксируют трансплантаты, поэтому их используют лишь при незначительных атрофиях.
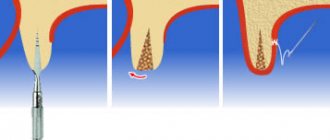
Техника использования
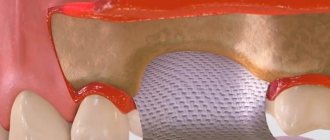
После заполнения операционной раны костным заменителем поверх него укладывается Cytoplast GBR-200 с перекрытием на 2-3 мм краев раны. Помимо самоприклеивания пленка может фиксироваться на ране с помощью легкого без натяжения ушивания лоскутов, уложенных поверх Цитопласта.
Удаляется мембрана на 21-25 день с момента проведения операции. Предельный срок – 28 дней. Повторная операция для удаления Цитопласта не требуется.
Если поверх мембраны был уложен и ушит лоскут, извлечение (вытаскивание) материала производится с помощью зонда через небольшое отверстие. В большинстве случаев обезболивания при этом не требуется (в крайнем случае, используется аппликационная анестезия), кровотечения, как правило, не возникает.
После покрытия операционной раны под Цитопластом начинает быстро формироваться кость и вторичный эпителий. Сращивание лоскута с вновь образованным эпителием происходит обычно через месяц-полтора после операции.
В видео смотрите технику использования мембраны Цитопласт.
Оголение мембран после костной пластики — последствия и лечение
Нерезорбируемая мембранная накладка обнажается в 1% случаев, вызывая следующие последствия:
- инфицирование раны с развитием гнойного воспаления;
- отторжение костнопластического материала при васкуляризации слизистой оболочки (в 40-50% случаев).
В таких ситуациях рекомендовано извлечь имплантированные материалы, провести лечение, а затем повторную костную пластику. Обычно под разрезом формируют второй слой мягких тканей при помощи слизисто-надкостничного лоскута. Для этого его отслаивают, расщепляют, моделируют, затем послойно ушивают.
Оголившуюся резорбируемую накладку нужно обрабатывать 3% перекисью водорода и 0,12 % хлоргексидина. Иногда это позволяет отодвинуть процедуру ее извлечения на 8 недель.
Мнение хирурга-стоматолога: «Большинство моих пациентов — курильщики. Многие не сразу осознают всю сложность ситуации, вызванной их вредной привычкой. Курение провоцирует резкое сужение кровеносных сосудов во рту. Это ослабляет приток крови, наполненной кислородом и питательными веществами. Из-за их недостатка процессы заживления затягиваются. Поэтому нужно полностью отказаться от курения минимум за пару недель до имплантации и на протяжении нескольких месяцев после нее».
Клинические результаты
С целью определения эффективности мембраны GBR-200 разработчиком проводились исследования материала на группе из 10 пациентов в 3-х клинических случаях:
- экстирпация зуба;
- экстирпация зуба с подсадкой остеозаменителя;
- экстирпация зуба с имплантацией.
Обеспечивались следующие условия проведения операции:
- выкраивание мембраны выполнялось ножницами по форме дефекта;
- при наложении мембрана перекрывала лунку на 2-3 мм;
- прилегание материала к ране обеспечивалось растягиванием и прижатием пальцами и инструментом с учетом конфигурации альвеолярного отростка;
- Цитопласт оставался на ране 21 день, после чего осторожно стягивался пинцетом.
Результаты исследований
- Ни в одном случае применения материала GBR-200 не возникло воспалительного процесса, клеточной пролиферации или иных отрицательных тканевых реакций.
- Ни одна из мембран не была отторгнута.
- Все пленки были легко удалены с раны через 21 день без использования анестезии.
- На раневой поверхности, находившейся под мембраной, не отмечалось резорбции окружающих тканей и прорастания эпителия. Лишь в некоторых местах по краям раны имели место мигрирующие незначительные участки эпителия.
- Раневая поверхность после снятия Цитопласта представляла собой вновь образованную костную структуру.
По результатам исследования был сделан вывод, что при использовании Цитопласт GBR-200 в течение 3-х недель на поверхности раны был создан надежный барьер, предотвративший прорастание эпителиальной ткани.
Направленная регенерация кости (НРК) используется для установки титановых дентальных имплантатов. Применение мембраны для исключения вмешательства неостеогенных тканей в регенерацию кости является ключевым принципом процедуры. Сегодня в экспериментах и клинической практике используют многочисленные разновидности стоматологических мембран.
Это требует свежей информации о свойствах материалов и биологических результатах, а также критической оценки биологических механизмов, регулирующих регенерацию кости в дефектах, покрытых мембранами.
Экспериментальные данные свидетельствуют, что различные модификации физико-химических или механических свойств мембран могут способствовать регенерации костной ткани. Тем не менее, роль пористости для барьерной функции этих продуктов все еще требует выяснения.
Новые экспериментальные данные указывают на активную роль мембранного компартмента в стимуляции регенеративных процессов. Оптимизация материалов путем систематического рассмотрения барьерных или биологических свойств, является важной стратегией в данной области научных исследований.
Основы направленной регенерации кости
Новые методы реабилитации при эдентулизме с использованием остеоинтегрированных имплантатов обусловила революцию в стоматологии и существенно улучшила качество жизни пациентов.
Тем не менее, потеря костной ткани или ее недостаточность, как признак разнообразных системных и периодонтальных заболеваний, травм и опухолей, остается серьезной проблемой для остеоинтеграции.
Чтобы достигать адекватного долгосрочного прогноза установки остеоинтегрированных имплантатов, предполагаемый участок имплантации должен содержать достаточный объем здоровой костной ткани.
Для восстановления утраченной кости применяют различные стратегии, такие как методы пересадки кости, альвеолярная дистракция и направленная регенерация кости (НРК), что позволяет полностью интегрировать имплантат и поддерживать его во время функциональной нагрузки.
Направленная регенерация считается одним из важнейших методов, наиболее часто применяемых для восстановления альвеолярной кости и лечения дефицита периимплантной кости.
НРК с использованием барьерных мембран для исключения определенных клеток, таких как быстро пролиферирующий эпителий и соединительная ткань, способствует росту медленно растущих клеток, способных к образованию кости. Метод часто сочетается с процедурами пересадки кости.
Направленная регенерация кости достигается, когда остеопрогениторным клеткам предоставляется возможность заселять участок костного дефекта, предотвращая проникновение неостеогенных тканей.
По оценкам зарубежных исследователей, порядка 40% остеоинтегрированных имплантатов потребуют проведения НРК как части стандартного плана стоматологической реабилитации.
В нескольких исследованиях указывалось, что выживаемость имплантатов в участках, аугментированных с помощью НРК, аналогичны тем, о которых сообщалось в отношении имплантатов в контрольных участках.
Коэффициент выживаемости имплантатов варьировал от 79% до 100%, причем в большинстве клинических исследований показатель выживаемости превышал 90% после как минимум 1 года функционирования.
Стоматологические мембраны являются важнейшим материалом для процедуры. Для производства этой продукции были предложены разные натуральные и синтетические материалы и их модификации:
- Синтетические мембраны из политетрафторэтилена: инертный и стабильный в биологических системах полимер, однако не подвергается естественной резорбции после внедрения.
- Синтетические мембраны из алифатических полиэфиров (PLA, PGA, PCL): характеризуются биорезорбируемостью, хорошей технологичностью и управляемостью, могут инкапсулировать лекарственные вещества, но не обладают достаточной жесткостью и прочностью.
- Натуральные мембраны из коллагена коров, свиней и других животных: характеризуются биорезорбируемостью, низкой иммуногенностью и способны инкапсулировать лекарства.
- Стоматологические мембраны из титана и сплавов кобальта и хрома: обладают достаточной механической прочностью и пластичностью, однако не являются резорбируемыми.
- Неорганические мембраны из фосфата кальция (гидроксиапатита): отличаются выраженными остеокондуктивными свойствами, но их прочность и пластичность недостаточная.
Для успеха направленной регенерации кости к материалу предъявляют ряд важных требований, включая биосовместимость, окклюзию клеток, полную интеграцию тканями хозяина, клиническую управляемость, способность создавать объем, адекватные механические и физические свойства.
Нерезорбируемые мембраны, в основном состоящие из политетрафторэтилена (ПТФЭ) в его модифицированной форме (е-ПТФЭ), составили первое поколение барьерных мембран.
В целом, эти типы продукта демонстрируют биосовместимость и способность создавать объем. Однако нерезорбируемые мембраны нуждаются в новом хирургическом вмешательстве для удаления барьера.
Впоследствии было разработано второе поколение мембран из рассасывающихся (резорбируемых) материалов, которое стало широко использоваться в различных клинических ситуациях. Недавно были предприняты усилия для разработки нового поколения продуктов с активным использованием материалов естественного происхождения и принципов тканевой инженерии в процессе производства.
Кроме того, использование мембран в дефекте вместе с костными трансплантатами или костно-замещающими материалами в настоящее время приветствуется для обеспечения структурной поддержки участка дефекта и для стимулирования внутреннего регенеративного потенциала ткани хозяина.
Ниже мы представляем исчерпывающий обзор попыток модификации свойств мембран и связанных с ними эффектов в свете биологических механизмов, регулирующих регенерацию костной ткани при НРК.
Клиническое применение направленной регенерации кости
Хотя этот обзор не посвящен клиническим результатам различных методов лечения НРК, существует необходимость в кратком изложении основных клинических показаний.
Резорбция альвеолярной кости ставит под угрозу структурные, функциональные и эстетические результаты процедуры дентальной имплантации. После потери зуба альвеолярная резорбция кости происходит сперва в горизонтальном направлении, в течение первых 6 месяцев, а затем в вертикальном направлении.
Существует несколько стратегий, направленных на увеличение объема альвеолярной кости, включая НРК, дистракционный остеогенез, расщепление гребня, свободные васкуляризированные аутотрансплантаты или поднятие дна верхнечелюстной пазухи.
Тяжесть потери костной ткани и конфигурация дефектов кости определяют тип, степень и прогноз лечения. Хотя клинические данные показывают высокую выживаемость имплантатов, помещенных в аугментированную кость, некоторые методы пока не имеют надежных доказательств долгосрочной клинической эффективности.
Принято считать, что увеличение объема костной ткани остается проблемой при вертикальных костных дефектах и прогрессирующей горизонтальной атрофии альвеолярных отростков.
Направленная регенерация кости является успешной, хорошо документированной и широко используемой процедурой для лечения дефектов альвеолярной кости в сочетании с дентальной имплантацией. Последние обзоры показали 95% выживаемость имплантатов после горизонтальной или вертикальной процедуры.
В настоящее время НРК подразумевает использование различных типов мембран (резорбируемых или нерезорбируемых) в сочетании с различными костно-замещающими материалами. Выбор материалов в значительной степени зависит от размера и конфигурации костного дефекта.
Клинические исследования показывают, что НРК является предсказуемым и успешным при горизонтальной аугментации дефектов, и в большинстве случаев успех может быть достигнут с помощью нерезорбируемых либо резорбируемых стоматологических мембран.
Резорбируемые мембраны считаются более удобными в использовании. Хотя превосходные результаты были получены и при использовании нерезорбируемых мембран, в нескольких публикациях указывается, что такие мембраны подвержены более высокой частоте осложнений.
В основном осложнения связаны с длительным воздействием на мягкие ткани. Правдоподобным объяснением осложнений можно считать напряжение в мягких тканях в сочетании с недостаточным снабжением сосудов.
Однако точные биологические механизмы воздействия мембран пока полностью не изучены. В случае воздействия резорбируемой мембраны часто отмечалось самопроизвольное заживление, что, возможно, является результатом быстрой деградации мембраны, а не разрастания мягких тканей.
Хотя горизонтальная аугментация имела более предсказуемый результат, чем вертикальная, во многих отчетах продемонстрировано положительное влияние НРК с использованием нерезорбируемых мембран из e-ПТФЭ.
В клинических исследованиях также использовалась усиленная титаном мембрана e-ПТФЭ в сочетании с костно-замещающими материалами для улучшения результатов вертикальной аугментации.
Хотя нерезорбируемые мембраны чаще использовались для вертикальных дефектов кости, недавние клинические исследования с использованием резорбируемых мембран на основе коллагена показали многообещающие результаты.
Как упоминалось ранее, основным осложнением, связанным с нерезорбируемыми мембранами, является воздействие через мягкие ткани. Осложнение чаще встречается при вертикальной аугментации кости, при которой недостаток мягких тканей клинически считается ограничивающим фактором.
Для улучшения исхода, особенно при сложных клинических случаях, обсуждались биоактивные регенеративные подходы, такие как применение рекомбинантных факторов роста в сочетании с НРК.
Исследования показали, что добавление рекомбинантного тромбоцитарного фактора роста человека-BB (rhPDGF-BB) с материалом для трансплантации кости под резорбируемой мембраной положительно влияет на заживление мягких тканей и обеспечивает лучшее сохранение кости после 1 года нагрузки на имплантат.
Тем не менее, нет убедительных клинических данных о положительном влиянии факторов роста, и развитие этой области остается несколько ограниченным из-за правового регулирования в некоторых странах мира.
Концентраты тромбоцитов, включая обогащенную тромбоцитами плазму и обогащенный тромбоцитами фибрин, были предложены в качестве дополнительных стимулов для регенерации кости.
Первоначально концентраты тромбоцитов использовались в качестве аутологичных каркасов при НРК или других областей применения в челюстно-лицевой хирургии. Концентраты тромбоцитов получают из крови пациента; эти препараты содержат тромбоциты и лейкоциты с потенциалом секретирования различных факторов роста и цитокинов, тем самым ускоряя заживление ран.
Предполагается, что обогащенный тромбоцитами фибрин способен выступать биологически активной мембраной для НРК, но было опубликовано лишь несколько клинических отчетов по этой теме.
Механические свойства и разрушение таких мембран могут быть проблемой.
Kawase и коллегам удалось снизить скорость биодеградации обогащенной тромбоцитами фибриновой мембраны, используя технику термического сжатия, которая не жертвовала биосовместимостью. Но до настоящего времени использование обогащенных тромбоцитами фибриновых мембран было менее документировано для НРК, чем для GTR.
Вместе взятые, клинические испытания, метаанализы и систематические обзоры демонстрируют успешные результаты с процедурами НРК для аугментации альвеолярного отростка и установки имплантата.
Однако некоторые клинические ситуации остаются противоречивыми, особенно в случаях вертикальной и прогрессирующей горизонтальной атрофии альвеолярного отростка.
В большинстве исследований использовались нерезорбируемые мембраны на основе е-ПТФЭ или резорбируемые мембраны на основе коллагена. Эволюция этих продуктов в основном обусловлена требуемой барьерной функцией, удобством для пациента и простотой обработки в различных клинических ситуациях.
Выбор стоматологических мембран для направленной регенерации кости
С химической точки зрения стоматологические мембраны для НРК которые можно классифицировать как синтетические полимеры, природные полимеры, металлы и неорганические соединения.
Синтетические полимеры
Первым зарегистрированным синтетическим полимером для НРК был е-ПТФЭ.
Он считается одним из наиболее инертных и стабильных полимеров в биологической системе. Он противодействует разложению тканями хозяина и не вызывает значимых иммунологических реакций.
Химическая стабильность e-ПТФЭ поддерживает структурную целостность и изолирующую функцию. Но воздействие e-ПТФЭ на полость рта приводит к миграции микроорганизмов и бактериальной инфекции, что может поставить под угрозу увеличение костной ткани и остеоинтеграцию.
Алифатические полиэфиры
представляют собой еще широко применяемую одну категорию синтетических полимеров: полимолочная кислота (PLA), полигликолевая кислота (PGA), поли-(ε)-капролактон (PCL), поли-гидроксилвалериановая кислота, поли-гидроксилмасляная кислота и их сополимеры.
Основными преимуществами данных типов полимерных стоматологических мембран являются их управляемость, технологичность, оптимальная биодеградация и возможность инкапсуляции лекарств.
Однако их деградация может вызвать сильный воспалительный ответ, приводящий к резорбции регенерированной кости. Их недостаточная жесткость и стабильность могут в некоторых случаях рассматриваться как основные недостатки.
Высокая скорость разложения алифатических сложных полиэфиров уменьшает время функционирования барьерной мембраны и способность создавать пространство, что влияет на результат регенерации кости.
Тем не менее, клинические исследования продемонстрировали возможность успешного использования мембраны из полиэфира для сохранения и увеличения альвеолярной кости после потери зубного ряда.
Фактически скорость резорбции этих продуктов в значительной степени зависит от типа полимера.
Например, PCL характеризуется более высокой гидрофобностью и меньшей растворимостью в воде, чем аналогичные мембраны из PLA и PGA. Продукты на основе сополимеров (например, лактид, ε-капролактон, гликолид и триметиленкарбонат) были предложены для снижения скорости резорбции.
Натуральные полимеры
Продукты на основе коллагена являются наиболее часто используемыми натуральными мембранами для направленной регенерации кости. Им уделяют большое внимание потому, что коллаген является основным компонентом соединительной ткани, обеспечивает адекватную структурную поддержку и является незаменимым компонентом в межклеточной коммуникации.
Коллагеновые мембраны
обладает множеством клинических применений, которые делают материал интересным для многих областей. Хотя известны сопоставимые клинические результаты между коллагеновыми и нерезорбируемыми мембранами, другие исследования показали, что коллагеновые продукты могут способствовать еще лучшему заживлению ран и регенерации кости.
Важнейшим недостатком коллагеновых мембран является их недостаточная жесткость. Следовательно, их использование более приемлемо в таких дефектах альвеолярного отростка, как дегисценция и фенестрация, которые не требуют дополнительной фиксации для стабильности.
В настоящее время на рынке предлагается широкий ассортимент этих продуктов.
Коллагеновые мембраны производят из бычьих и свиных тканей (например, сухожилий, дермы и тонкой кишки), а их биодеградация варьирует в зависимости от источника происхождения. Скорость деградации коллагеновой мембраны может не соответствовать оптимальной регенерации ткани.
Ряд специальных технологий физического / химического сшивания был использован для оптимизации механических свойств коллагеновой мембраны и замедления скорости деградации. Эти методы включают ультрафиолетовое (УФ) излучение и обработку химическими растворами, такими как генипин (Gp), глутаральдегид и гидрохлорид 1-этил-3- (3-диметиламинопропил) карбодиимида (EDC).
Хотя химическое сшивание привело к улучшению стабильности коллагена, остатки химических веществ (например, амидов или альдегидов) могут вызвать сильное воспаление в участке имплантации.
Таким образом, предсказуемость коллагеновой мембраны зависит не только от происхождения коллагенового материала, но также от процедур подготовки и обработки (децеллюляризация, стерилизация и сшивание).
Природные соединения, такие как Gp и D-рибоза, были предложены в качестве безопасных, нетоксичных, неиммуногенных агентов для обеспечения высокой механической прочностью и низкой скорости разложения.
Мембраны на основе коллагена также получают из человеческого организма. Ацеллюлярный дермальный матрикс (ADM) производится из кожи человека после удаления эпидермиса и всех кожных клеток.
Было показано, что структура коллагена и эластина внеклеточного матрикса (ECM), а также эндогенные факторы роста сохраняются в ADM после децеллюляризации. Биомеханический анализ показал, что ADM имеет лучшую прочность и жесткость, чем целлюлярная дермальная мембрана.
За рубежом ADM клинически использовался для сохранения альвеолярных отростков и лечения периимплантационных дефектов.
Другие типы коллагеновых мембран получены из перикарда и твердой мозговой оболочки человека.
Также были попытки использовать человеческие структуры амниона для изготовления биосовместимых мембран с использованием методов децеллюляризации и стерилизации. Лиофилизированная многослойная амниотическая мембрана сохраняет структурные и механические свойства ECM амниона и обладает достаточной гибкостью в регулировании толщины и механических свойств.
Предполагается, что данная мембрана способствует интенсивному росту костной ткани, одновременно ограничивая проникновение фиброзной ткани, то есть выполняя изолирующую функцию.
Хитозан
— еще один природный полимер, используемый для приготовления мембран НРК. Данный материал состоит из сополимеров глюкозамина и N-ацетилглюкозамина. Он может быть получен посредством частичного деацетилирования хитина.
Последний материал присутствует в раковинах ракообразных (в креветках и крабах), где он играет роль, аналогичную роли коллагена у высших животных. Хитозан обладает важнейшими свойствами, включая биосовместимость, биоразлагаемость, низкую иммуногенность и бактериостатический эффект.
Скорость деградации хитозановых мембран зависит от молекулярной массы, а также от технологии производства. Как и коллаген, хитозан может сшиваться с помощью глутарового альдегида и Gp.
Однако из-за токсичности глутаральдегида и высокой стоимости Gp в качестве альтернативного метода сшивания было предложено использование триполифосфата натрия.
Альгинатные мембраны
также были применяются для направленной регенерации кости.
Альгинат представляет собой биосовместимый анионный полимер, который обычно получают из бурых водорослей. При сшивании с гидрогелями он имеет структуру, аналогичную внеклеточному матриксу.
Хотя есть свидетельства того, что мембраны на основе как хитозана, так и альгината способствуют регенерации кости при экспериментальных костных дефектах и являются подходящими материалами, надежные клинические доказательства в пользу этих материалов в мире не опубликованы.
Титан и другие металлы
Титан является широко используемым материалом в стоматологии, черепно-лицевой хирургии и ортопедии.
Среди его преимуществ — биосовместимость, высокая прочность и жесткость, низкая плотность и вес, способность выдерживать высокие температуры и устойчивость к коррозии. Использование титана для НРК было вдохновлено отличным результатом титановой сетки при восстановлении челюстно-лицевых дефектов.
Множество зарубежных исследований показали, что использование титановой сетки отдельно и в сочетании с заменителями кости является эффективным вариантом для локального аугментации альвеолярного отростка до или одновременно с установкой дентального имплантата.
Окклюзивный титан и микроперфорированная титановая мембрана также использовались для лечения дефектов периимплантных участков и аугментации альвеолярного отростка. В нескольких исследованиях ученые сравнивали биосовместимость титана с другими мембранными материалами.
Существуют экспериментальные доказательства, что титан вызывает менее стойкое воспаление, чем ПТФЭ.
Сплав на основе кобальта и хрома
(CoCr) также был предложен для НРК. Хотя этот сплав, как известно, является менее биосовместимым, чем титан или титановый сплав, он обладает отличными механическими свойствами (например, жесткостью и ударной вязкостью).
Возможность применения сплава CoCr для направленной регенерации кости было оценено в недавних исследованиях на животных, но оно еще не было задокументированы ни в одном клиническом отчете.
Decco и соавторы сообщают, что размещение мембраны CoCr в дефекте большеберцовой кости кролика обеспечивает достаточный объем и способствует регенерации кости.
Неорганические материалы
Сульфат кальция является одним из немногих неорганических соединений, которые использовались для массового производства мембран. Это биосовместимый, остеокондуктивный и биорезорбируемый материал. Материал образуется в естественной среде и может быть получен синтетическим путем.
Мембраны на основе кальция сульфата получают путем гидратации порошка гемигидрата (парижского гипса). Последний дает пасту, которую можно формовать и вводить в жесткий материал с относительно стабильными, менее резорбируемыми кристаллами.
Мембрана на основе гидроксиапатита
(ГАП) также применяют для НРК. Гидроксиапатит — материал на основе фосфата кальция, широко используемого в остеопластике из-за сходства с естественным костным минералом, биосовместимости и остеокондуктивности.
ГАП резорбируется меньше, чем многие другие материалы на основе фосфата кальция. Хотя ГАП считается относительно хрупким, он демонстрирует адекватные механические свойства, позволяя мембране выдержать статическое давление со стороны мягких тканей и сохраняя больше места для регенерации кости.
Было показано, что стоматологические мембраны с гидроксиапатитом способствуют высокой функциональной активности стромальных и остеобластоподобных клеток in vitro и индуцируют формирование кости in vivo.
Порошок ГАП, используемый для приготовления чистой керамической мембраны или продуктов других типов, также комбинируют с биологически активными ионами, включая стронций, серебро и цинк, чтобы повысить их биологическую эффективность in vivo.
Другие керамические материалы, такие как бета-трикальцийфосфат
(β-ТКФ), были включены в резорбируемые мембраны и продемонстрировали проостеогенные эффекты in vitro и in vivo.
Кроме того, добавление биоактивных наночастиц стекла к биорезорбируемым мембранам повышает метаболическую активность и минерализацию клеток in vitro.
При использовании коллагеновой мембраны с биоактивным стеклом было продемонстрировано усиление регенерации кости по сравнению с нативной коллагеновой мембраной.
Свойства стоматологических мембран
Для успеха направленной регенерации кости и последующей имплантации стоматологические мембраны обязаны обладать определенными свойствами. Перечислим важнейшие из них.
Жесткость и пластичность
Количество регенерированной кости в дефекте кости будет уменьшено, если мембрана разрушается.
Следовательно, идеальный материал должен быть достаточно жесткой, чтобы выдержать сжатие вышележащей мягкой ткани. При этом он должен обладать определенной степенью пластичности, чтобы его можно было легко контурировать, придавая форму дефекта.
Баланс между этими механическими характеристиками необходим для достижения адекватного объема пространства. Титан обладает прекрасными механическими свойствами по сравнению с другими типами материалов, такими как бычий коллаген или е-ПТФЭ.
В то время как жесткость предотвращает разрушение мембраны и обеспечивает поддержание объема, его пластичность позволяет изгибать и адаптировать материал к дефекту. Но срезанные края титановой сетки иногда вызывают раздражение слизистой оболочки, приводя к обнажению мембраны и инфекции.
В исследовании на кролике размещение титановой мембраны на дефекте верхней челюсти вызывало более высокую степень регенерации кости по сравнению с продуктом из ПТФЭ (Lundgren et al., 1998). Это было в основном связано с сохранением объема титановой мембраны.
Для повышения жесткости мембраны из ПТФЭ титановый каркас встраивают в структуру мембраны, что обеспечивает дополнительную стабильность мембраны при лечении. Такая модификация также позволила плавно изменять форму мембраны в соответствии с особенностями случая.
С другой стороны, из-за недостаточной жесткости, особенно в случае резорбируемых мембран, дефект кости часто заполняется костно-замещающим материалом для предотвращения разрушения и сохранения объема.
Мини-винты и штифты также использовались для стабилизации мембраны в окружающей кости, чтобы уменьшить риск коллапса. Кроме того, была предложена методика с использованием шатрового винта для обеспечения и поддержания требуемого пространства во время аугментации гребня.
Фосфаты кальция включают в резорбируемые мембраны для улучшения механических свойств. Например, включение β-ТКФ в полимерный продукт, изготовленный из PCL/PLGA, может увеличивать механическую стабильность и стимулировать регенерацию кости in vivo.
Также было показано, что механические свойства коллагенового и поливинилового матрикса значительно улучшаются после добавления композита β-ТКФ / хитозан и нано-гидроксиапатита, соответственно.
Кроме того, композитный продукт на основе ГАП и аминокислотного сополимера с низким содержанием нанокальция продемонстрировал адекватные биомеханические свойства. Интересно, что для оптимизации механических свойств были разработаны трехслойные мембраны на основе коллагена.
В то время как верхний и нижний слои мембраны состоят из гидроксиапатит-содержащего коллагена для лучшей гибкости и биологической активности, средний слой состоит из хитозана для обеспечения высокой прочности и повышения эластичности всей конструкции.
Было показано, что прочность на сжатие PLLA мембраны возможно регулировать путем изменения молекулярной массы полимера.
По сравнению с мембраной на основе PLLA с молекулярной массой 100 000 продукт на основе PLLA с молекулярной массой 380 000 демонстрирует более высокую прочность на сжатие, равную прочности титановой сетки, и считается удачным выбором для вертикальной аугментации.
Пористость материала
Пористость является важным свойством стоматологической мембраны.
Опубликованные до настоящего времени исследования касались роли пористости в индуцировании биологического ответа in vivo с использованием резорбируемых и нерезорбируемых мембран.
Размер пор влияет на степень регенерации кости в нижележащем изолированном пространстве.
Считается, что этот показатель тесно связан с окклюзией тканей и оказывает существенное влияние на проникновение в клетки мягких тканей. Сообщалось также, что поры способствуют диффузии жидкостей, кислорода, питательных веществ и биологически активных веществ для роста клеток.
Тем не менее, наличие слишком больших пор может ухудшить окклюзионные свойства, позволяя клеткам мягких тканей мигрировать через мембрану. Они перенаселяют участок дефекта, подавляя инфильтрацию и активность остеопрогениторных клеток.
Сообщалось, что наличие пор размером от 5-30 мкм в e-ПТФЭ мембране способствует бактериальной контаминации и прочному прикреплению мягких тканей. Поэтому был разработан плотный d-ПТФЭ с субмикронными порами (0,2 мкм), не допускающими миграции бактерий в структуру.
Более высокая адгезия у вида Actinobacillus actinomycetemcomitans, Treponema denticola и Porphyromonas gingivalis была обнаружена на коллагеновых мембранах, чем на e-ПТФЭ и d-ПТФЭ, но никаких различий в бактериальной адгезии микроорганизмов между ПТФЭ обнаружено не было.
В нескольких исследованиях указывалось, что использование d-ПТФЭ предотвращает проникновение микроорганизмов, подавляет инфекцию в участке регенерации и даже не требует первичного закрытия.
Более низкая пористость сделала мембраны из ПТФЭ менее склонными к прикреплению мягких тканей и, таким образом, их можно легко удалить без необходимости дополнительных хирургических процедур.
Однако минимальная интеграция тканей с мембранами из d-ПТФЭ создает потенциальные проблемы для первоначального образования сгустка, стабилизации раны и стабильности мембраны.
Было показано, что размещение e-ПТФЭ, содержащего поры 300 мкм, в комбинации с титановыми имплантатами обеспечивает достаточное пространство и значительное вертикальное увеличение кости.
Как в микроскопическом, так и в макроскопическом масштабе Lundgren и его коллеги изучали влияние размера пор на НРК у крыс, используя жесткую пластиковую пластину в качестве твердой или окклюзионной мембраны и шесть сеток из полиэфира с различной пористостью (10, 25, 50, 75, 100 и 300 мкм).
Низкая скорость увеличения костной ткани была связана с окклюзионным барьером. Напротив, размещение сеток из полиэфира с перфорацией, превышающей 10 мкм, приводит к более высокой скорости наращивания костной ткани, чем при использовании сеток с порами 10 мкм.
Эти и другие экспериментальные данные показывают, что более пористые мембраны (20-25 или 100 мкм) вызывают более быструю и эффективную регенерацию по сравнению с мелкопористыми материалами.
Более того, согласно данным, предоставленным Gutta и коллегами, макропоры в титановой мембране диаметром более 1 мм способствуют лучшей регенерации кости.
Последнее наблюдение подтверждается тем фактом, что, хотя титановая сетка имеет макропористую структуру и предположительно допускает миграцию неостеогенных мягких тканей к месту дефекта, она все еще остается одной из самых предсказуемых опций для горизонтальной и вертикальной аугментации.
Хотя предположено, что менее пористая полилактидная мембрана сохраняет остеогенные компоненты в дефектном участке, ряд авторов утверждают, что наличие больших отверстий (800–900 мкм) обеспечивает адекватную васкуляризацию для при лечении крупных дефектов кости.
В действительности размер пор и степень пористости доступных мембран отличаются, и оптимальная пористость мембраны до настоящего времени не определена.
Необходимы дальнейшие систематические исследования для решения следующих вопросов. Во-первых, действительно ли стоматологическая мембрана для НРК должна быть пористой? Во-вторых, какова роль пористости и проницаемости в механизме заживления кости?
Архитектура и толщина мембраны
Коллагеновые мембраны имеют различную структуру и толщину в зависимости от источника коллагена, способа экстракции и метода производства продукта. Они могут состоять из гомогенного коллагенового матрикса или двухслойной структуры.
Ультраструктурная оценка показала, что мембрана Jason состоит из коллагеновых волокон различной ориентации, формирующих гребнеобразную структуру с сильной разнонаправленной связью. Продукт DynaMatrix имеет дискретные слои коллагеновых твердых оболочек. Collprotect принято считать полупроницаемой из-за открытой пористой и трехмерной структуры.
Двухслойные мембраны, такие как BioGide и Mucograft, имеют один компактный слой, который способен предотвращать проникновение эпителиальных клеток в дефект кости. Второй же, пористый губчатый слой конструкции отвечает за тканевую интеграцию. Данную структуру имитировали для синтетической коммерческой мембране из сополимера гликолида и триметилинкарбоната (Resolut).
В другой двухслойной полимерной мембране Guidor два слоя выполнены в виде сетки, но с разным размером пор и геометрией. В то время как внешний слой имел большие поры прямоугольной формы, чтобы обеспечить интеграцию вышележащей мягкой ткани и способствовать интеграции ткани, внутренний слой имел относительно небольшие поры круглой формы для ограничения проницаемости ткани.
Фактически, конструкция и архитектура полимерных мембран являются важнейшими факторами биорезорбируемости и остеопромоторного эффекта in vivo.
Мембраны, описанные выше, отличаются не только по своей архитектуре, но также по толщине, что может влиять на их механические и сохраняющие пространство свойства при имплантации.
Известно, что размещение более толстой коллагеновой мембраны обеспечивает меньшее врастание мягких тканей и способствует лучшему образованию кости.
Наконец, сборка двух слоев одного и того же типа несшитой коллагеновой мембраны уменьшает резорбцию костного трансплантата и улучшает регенерацию кости, а также удерживает тело мембраны в течение более длительного периода времени.
В совокупности данные, опубликованные разными авторами, свидетельствуют об активной роли мембраны в стимулировании регенеративных процессов при НРК. Это больше, чем пассивный барьер.
С другой стороны, пока неизвестно, будут ли разные мембраны обладать разным потенциалом мобилизации и активации мембранно-рекрутированных клеток, и приведет ли это к разным результатам в образовании кости и регенерации костного дефекта.
Важно получить такую информацию для принятия полностью обоснованных решений в клинической практике и разработки более совершенных стоматологических мембран следующего поколения.
Отзывы
Использование барьерных мембран при оперативных вмешательствах является новой, современной технологией, не получившей пока еще того распространения, которого она заслуживает.
Если вы подвергались операции с использованием барьерных мембран Цитопласт, поделитесь своим впечатления об этом материале с другими посетителями нашего сайта, оставьте свой комментарий внизу страницы.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Теги имплантация методы имплантации
Понравилась статья? Следите за обновлениями
Предыдущая статья
Спасать или удалять зуб при гнойном периодонтите?
Следующая статья
Универсальный трейнер I-3 для коррекции дефектов прикуса у детей
Диагностика
Для выявления эпиретинального фиброза необходимо исследование глазного дна, для чего назначается офтальмоскопия. Обследование в проходящем свете обнаруживает ее поблескивание над областью желтого пятна, напоминающее отражение от целлофановой пленки.
Эпиретинальная мембрана в начальной стадии очень тонкая, ее можно и не заметить, что затрудняет диагностику. Однако, если существует подозрение на ее наличие, для подтверждения диагноза, назначают ультразвуковое обследование. Также оно необходимо при непрозрачности оптических сред (стекловидного тела, хрусталика, роговицы), что затрудняет исследование глазного дна с помощью офтальмоскопии.
Еще одним диагностическим методом при эпиретинальном фиброзе является оптическая когерентная томография, которая помогает выяснить размер и структуру мембраны.
Степень нанесенного мембраной вреда дает возможность определить флюоресцентная ангиография, которая показывает масштаб макулярного отека. Насколько ухудшилось зрение пациента, определяют с помощью теста «решетка Амслера» и визометрии.
Рис.2 Витреоретинальный хирург в операционной при выполнении витрэктомиии и макулярного пилинга.