Анестезия в стоматологии
Лучшие препараты для локального обезболивания в стоматологии
Как мы сказали, чаще всего в стоматологических клиниках применяются препараты на основе артикаина, в частности, Ультракаин или Убистезин. Теперь, с учетом изложенной информации, пора детальнее остановиться на преимуществах подобных анестетиков.
Артикаин
Современная местная анестезия в стоматологии немыслима без артикаина. Именно этот анестетик обладает минимальным соотношением токсичности и обезболивающей активности. Другими словами, среди самых эффективных средств он наименее токсичен.
Артикаин активно используют для инфильтрационного и проводникового обезболивания. Применяют его и для внутрикостной анестезии перед стоматологическими операциями. А вот поверхностноанестезирующее действие для артикаина не характерно, из-за чего для аппликаций он не пригоден.
Преимущество артикаина — высокая эффективность при воспалении. (Воспалительный процесс снижает действие многих препаратов). Эта особенность позволяет использовать Ультракаин или Убистезин при лечении гнойно-воспалительных заболеваний зубов и периодонта.
Благодаря низкой токсичности артикаин является лучшим средством для детской стоматологии, людей пожилого возраста, пациентов с заболеваниями гепатобилиарной и мочевыделительной систем. Можно использовать при грудном вскармливании. В грудное молоко артикаин практически не проникает, а если и обнаруживается в нем, то в крайне низких концентрациях, не имеющих никакого клинического значения.
Можно ли использовать артикаин при беременности? Исследования показали, что хотя артикаин проникает через плацентарный барьер, он не оказывает токсичного или мутагенного действия на плод. При беременности артикаин использовать можно.
Недостаток артикаина в средней продолжительности действия. Он быстро всасывается в кровь, быстро разрушается и выводится с мочой. Отчасти это объясняется тем, что артикаин, как и многие местные анестетики, расширяет сосуды. По этой причине артикаин часто используют вместе с вазоконстрикторами, которые уже включены в состав препарата. Например:
- Ультракаин ДС Форте, Убистезин Форте содержат адреналин в концентрации 1:100 000 (средняя концентрация).
- Ультракаин ДС, Убистезин содержат адреналин в концентрации 1:200 000 (невысокая концентрация).
Как быть, если пациент относится к группе риска, и ему нельзя колоть анестетик с адреналином? В таком случае нужно использовать Ультракаин Д — препарат с артикаином без сосудосуживающего компонента.
При беременности рекомендуется использовать артикаин в сочетании с адреналином в невысокой концентрации (Убистезин, Ультракаин ДС). Некоторые специалисты считают, что лучше вообще не использовать вазоконстрикторы при лечении беременных. Какой вариант лучше? Выбор нужно делать с учетом индивидуальных особенностей. Женщине следует проконсультироваться со специалистами, в том числе с гинекологом, который наблюдает беременность.
Лидокаин
Лидокаин — еще один популярный и широко используемый препарат, несмотря на то, что он в 2 раза токсичнее прокаина. Преимущество лидокаина в средней продолжительности действия и более выраженном эффекте (он в 4 раза сильнее прокаина). Проблема в том, что лидокаин расширяет сосуды, что требует одновременного использования высоких доз сосудосуживающего препарата. По этой причине лидокаин редко используют для проводникового или инфильтрационного, но часто применяют для поверхностного обезболивания.
Можно ли использовать лидокаин при беременности? Один недостаток мы уже назвали — препарат требует применения адреналина в большой концентрации. Второй недостаток лидокаина в том, что он токсичен, проникает через плаценту и накапливается в печени плода. Учитывая вышесказанное, местная анестезия с лидокаином беременным противопоказана.
Мепивакаин
Уникальный препарат, ведь это единственный анестетик для локального обезболивания с сосудосуживающим действием. Эта особенность позволяет использовать мепивакаин без вазоконстриктора, что делает его лучшим средством для оказания анестезиологического пособия пациентам из групп риска (диабет, болезни щитовидной железы, гипертония и другие сердечно-сосудистые заболевания).
Мепивакаин активно применяется для инфильтрационного и проводникового обезболивания. При беременности противопоказан, поскольку проникает через плацентарный барьер и сужает маточные артерии, что может привести к гипоксии плода.
Обезболивание в детской стоматологии
Проблема анестезии в детской стоматологии стоит достаточно остро, поскольку маленьким пациентам психологически и физически сложно выдержать длительную процедуру лечения. С одной стороны, их пугает шум стоматологических приборов, с другой — им просто сложно высидеть неподвижно на протяжении 40-60 минут. В связи с этим вместо местного обезболивания врач-стоматолог может рекомендовать наркоз.
Наркоз в детской стоматологии проводится с применением современного препарата — Севоран. В отличие от популярной ранее ЗАКС (закись азота-кислородная смесь), Севоран сочетает не только высокую эффективность (достаточная глубина и длительность медикаментозного сна), но также максимальную безопасность и очень «чистый» выход из наркоза. После пробуждения ребенок чувствует себя прекрасно, головные боли, тошнота или головокружение встречаются крайне редко.
Узнать больше о способах оказания анестезиологического пособия в детской и взрослой стоматологии вы можете на консультации врача стоматолога медицинского .
Записаться на прием
Непереносимость местных анестетиков. Алгоритм выбора препарата
В статье обсуждается проблема выбора препарата для местной анестезии с точки зрения предотвращения развития побочных реакций, связанных с его клиническим применением, приводятся основные правила подбора препарата в группах риска.
Таблица. Классификация местных анестетиков
Введение
Эффективность и безопасность – это главные требования, предъявляемые к фармакологическим препаратам, используемым для лечения, профилактики и диагностики заболеваний, а также основные критерии успешного применения лекарственных средств (ЛС) в клинической практике. Одновременно с ростом числа ЛС увеличивается и возможность развития различных нежелательных реакций. Побочные реакции, возникающие при использовании ЛС, встречаются у 1/10 части населения планеты, но только 10% из них обусловлены лекарственной гиперчувствительностью [1]. Эти реакции могут различаться клинической картиной, степенью тяжести и иметь разные исходы.
Как правило, фармакологические свойства лечебных и диагностических препаратов хорошо известны. Однако реакции гиперчувствительности врач не всегда может прогнозировать [1].
Побочная реакция на ЛС – это неожиданный нежелательный эффект, возникающий при применении препарата в терапевтической (профилактической, диагностической) дозе.
Лекарственная аллергия – это повышенная чувствительность к лекарственному препарату, в основе которой лежат иммунологические механизмы.
Типы нежелательных реакций, возникающих при использовании ЛС
Выделяют два типа нежелательных реакций, возникающих при использовании фармакологических средств.
Первый тип реакций – предсказуемые побочные действия, связанные с фармакологическим действием ЛС, зависят от используемой дозы, могут проявляться у любого пациента, составляют 75% всех побочных реакций на фармакологические средства. В фармацевтических справочниках и инструкциях по применению ЛС содержатся указания на возможность развития подобных реакций. Ниже представлены примеры прогнозируемых побочных реакций:
- токсичность препарата;
- токсические реакции, связанные с передозировкой и/или кумуляцией препарата;
- реакции, обусловленные фармакологическими свойствами ЛС;
- реакции, вызванные взаимодействием ЛС;
- тератогенное действие ЛС;
- канцерогенное действие ЛС;
- смешанные реакции [2].
Побочные реакции второго типа непредсказуемы и связаны с реактивностью, а иногда генетическими особенностями пациента. Назовем варианты непредсказуемых побочных реакций:
- Неаллергическая врожденная гиперчувствительность (идиосинкразия). Обусловлена недостаточностью ферментов.
- Лекарственная гиперчувствительность:
- аллергическая гиперчувствительность (истинные аллергические реакции: иммуноглобулин E(IgE)-опосредованные и не IgE-опосредованные). В этих реакциях участвуют иммунологические механизмы;
- неаллергическая гиперчувствительность (псевдоаллергия). Развивается без участия иммунологических механизмов [2].
Неаллергическая врожденная гиперчувствительность (идиосинкразия, ферментопатия) – недостаток или неполная активация фермента, участвующего в метаболизме ЛС. Медикаментозные или диагностические средства могут воздействовать на ферментные системы, участвующие, например, в инактивации сывороточных кининов. При недостаточности глюкозо-6-фосфатдегидрогеназы применение окислителей может привести к развитию у пациента гемолитической анемии. Индуцировать гемолиз у этой группы больных могут и сульфаниламиды, нитрофураны, препараты витамина К.
Реакции неаллергической гиперчувствительности, или псевдоаллергические реакции, не имеют иммунологических механизмов, но могут имитировать симптомы аллергической реакции. Развитие псевдоаллергических реакций при применении фармакологических средств может быть связано с прямым или опосредованным высвобождением гистамина из тучных клеток и базофилов, происходящим под влиянием применяемого лекарственного препарата. Некоторые ЛС способны неиммунным путем активировать систему комплемента по альтернативному пути. В результате накапливаются промежуточные продукты активации, обладающие свойствами анафилотоксинов, что приводит к повышению проницаемости мембран, дегрануляции тучных клеток и высвобождению гистамина. Псевдоаллергические реакции могут иметь и иные механизмы. Нестероидные противовоспалительные препараты, салицилаты, тартразин могут вызывать нарушение метаболизма арахидоновой кислоты. Накопление брадикинина может происходить при лечении ингибиторами ангиотензинпревращающего фермента. При использовании сульфитов образуется оксид серы, обладающий свойствами бронхоконстриктора [2].
Аллергические реакции отличает участие иммунологических механизмов в их формировании. Такие реакции встречаются у небольшого количества пациентов, развитие их непредсказуемо. Постановка диагноза лекарственной аллергии представляет собой очень серьезное решение. В случае ошибочного отрицания лекарственной аллергии на ЛС дальнейшее его использование может привести к трагическому исходу. При гипердиагностике лекарственной аллергии пациент лишается возможности использования целой группы (иногда нескольких групп) препаратов, порой ему необходимых [3, 4].
При использовании ЛС возможно развитие психофизиологических побочных реакций. Они могут возникать у больных истерическим неврозом, при вегетативных расстройствах, а также у пациентов, перенесших в прошлом тяжелые осложнения лекарственной терапии.
Классификация местных анестетиков
Появление большого количества современных, малотоксичных местных анестетиков (МА) привело к расширению их использования в различных областях медицины и, к сожалению, к увеличению числа пациентов, у которых развиваются различные побочные реакции при их назначении. Местные анестетики – это лекарственные средства, которые обратимо угнетают возникновение и проведение импульсов в периферических нервах и нервных окончаниях, что приводит к потере чувствительности в ограниченных участках тела [5, 6]. Виды местной анестезии варьируют в зависимости от ее клинического применения в разных областях медицины:
- поверхностная анестезия – нанесение МА на кожу, конъюнктиву глаза, слизистую оболочку полости носа, рта, трахеобронхиального дерева, мочевых путей, в полость уха;
- инфильтрационная – стоматология, небольшие хирургические вмешательства;
- проводниковая анестезия – введение препарата в область нерва или сплетения;
- эпидуральная – введение МА между твердой мозговой оболочкой и надкостницей, выстилающей внутреннюю поверхность позвоночного канала;
- спинномозговая – введение МА непосредственно в цереброспинальную жидкость;
- внутривенная регионарная анестезия.
Применение этой группы ЛС не ограничивается сферой медицины. В косметических салонах перед проведением болезненных процедур МА наносят на кожу или применяют инъекционно. Пациент может сенсибилизироваться к препарату и забыть о том, что он получал процедуры у косметолога с применением МА. Чаще всего при опросе пациент не упоминает о таком применении МА и почти никогда не знает, какой именно препарат использовался. Это одна из причин разных по степени тяжести, а иногда и смертельных осложнений различных косметических процедур.
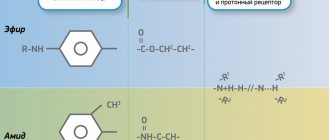
Химическое строение МА определяет их физико-химические характеристики и клинические свойства. Местные анестетики состоят из гидрофобной (липофильной) ароматической группы, промежуточной эфирной или амидной цепи и гидрофильной вторичной или третичной аминогруппы. Большинство МА являются третичными аммониевыми основаниями, которые применяют в виде растворов водорастворимых солей, в основном гидрохлоридов. В основном препараты различаются по растворимости в липидах, связыванию с белками тканей и константе диссоциации [5, 6].
В зависимости от промежуточной цепи МА делятся на эфиры и амиды (таблица). Первая группа местных анестетиков (группа эфиров) включает сложные эфиры бензойной кислоты (кокаин, Бенкаин), сложные эфиры парааминобензойной кислоты (прокаин, бутамбен), сложные эфиры аминобензойной и бензойной кислот (тетракаин). Эфирные МА относительно нестабильны в растворах и в организме быстро гидролизуются псевдохолинэстеразой и некоторыми другими эстеразами. Один из продуктов гидролиза – парааминобензойная кислота, которая может вызывать аллергические реакции. Период полувыведения в плазме у этих препаратов очень короткий, поэтому их распределение в тканях плохо изучено.
Ко второй группе МА (группа амидов) относят амиды гетероциклической и ароматической кислот (Совкаин, Новокаин), амиды ароматических аминов – анилиды (лидокаин, бупивакаин, мепивакаин, ропивакаин и др.). Амидные МА относительно стабильны в растворе и медленно гидролизуются микросомальными ферментами печени. Скорость метаболизма разных препаратов весьма вариабельна: прилокаин – самый быстро метаболизируемый препарат, бупивакаин – самый медленный. У пациентов с нарушением функции печени амидные МА могут оказывать токсическое действие из-за удлинения периода полувыведения препарата; уменьшение печеночного кровотока приводит к замедлению инактивации МА.
Небольшое количество препаратов выводится в неизмененном виде почками. Значительная доля МА после введения поступает в системный кровоток. Количество всосавшегося препарата и его пиковая концентрация в плазме зависят от дозы и присутствия в растворе вазоконстриктора (особенно при проводниковой и инфильтрационной анестезии). Одна и та же доза МА сопряжена с разным риском токсического воздействия и зависит от методики анестезии, степени васкуляризации тканей и взаимодействия с липидами тканей. Анестетики активно всасываются через слизистые оболочки. Связывание МА с белками плазмы влияет на фармакокинетику и фармакодинамику. Анестетики группы эфиров связываются с белками плазмы незначительно (
Перекрестные реакции местных анестетиков
Многие лекарственные средства имеют сходную химическую структуру и обладают перекрестными аллергенными свойствами. Среди МА эфирной группы перекрестные аллергические реакции встречаются довольно часто. Пациенту, страдающему аллергией к Новокаину, нельзя применять Анестезин, Дикаин. Между препаратами группы амидов и анилидов перекрестные аллергические реакции встречаются достаточно редко. Результаты исследований (аппликационные тесты) свидетельствуют о возможности развития перекрестных аллергических реакций между лидокаином, прилокаином, мепивакаином. Перекрестные аллергические реакции между препаратами первой (эфирной) и второй (амидной) групп отсутствуют. По многочисленным данным, применение МА группы амидов и анилидов значительно реже приводит к развитию побочных реакций, как аллергических, так и неаллергических.
МА эфирной группы, являясь производными бензойной, аминобензойной и парааминобензойной кислот, имеют общие антигенные свойства с препаратами, имеющими парааминогруппу и бензолсульфонамидную группу [2, 4]. Парааминогруппу содержат Новокаин и другие эфиры бензойной кислоты; Меновазин, Анестезол, Альмагель А и другие комбинированные лекарственные средства; Новокаинамид; сульфаниламиды; парааминобензойная кислота и ее производные; парааминосалициловая кислота и ее производные; этакридина лактат. Бензолсульфонамидную группу имеют сульфаниламиды; сульпирид; производные сульфонилмочевины (сахароснижающие, сульфокарбамид); диуретики, содержащие сульфамидную группу, связанную с кольцом бензола; тиазидные диуретики; ингибитор карбоангидразы; соталол; производные парааминобензойной кислоты; парааминосалициловая кислота. При аллергии к препаратам этих групп нельзя использовать МА эфирной группы.
Пациент может сенсибилизироваться, применяя лекарства, в состав которых входят МА. Так, бензокаин (Анестезин) входит в состав препаратов Альмагель А, Анбитал, Белластезин, Павестезин, Меновазин, свечей Анестезол. Лидокаин содержится в препаратах Ауробин, Лидактон, Стрепсилс Плюс, свечах Прокто-Гливенол, Лидохлор (гель для местного применения, содержит лидокаина гидрохлорид и хлоргексидина глюконат).
Прокаин (Новокаин) входит в состав Солутана, мази и свечей Гемороид, Сульфокамфокаина (комплексное соединение сульфокамфорной кислоты и Новокаина). Тримекаин содержится в мазях Диоксиколь, Диоксизоль, Левосин.
На практике перекрестная реактивность фармакологических средств учитывается не всегда. Нельзя забывать, что комплексные препараты могут содержать вещество, к которому пациент сенсибилизирован.
Побочное действие местных анестетиков
Местные анестетики могут вызывать токсические, аллергические и псевдоаллергические реакции. Большинство побочных эффектов, возникающих при применении МА, связано с вегетативно-сосудистыми расстройствами, страхом перед оперативным вмешательством или стоматологическими манипуляциями, токсическими, истерическими реакциями. Иногда побочное действие оказывают входящие в состав некоторых местноанестезирующих средств вазоконстрикторы. Истинные аллергические реакции на МА возникают редко [7, 8].
Токсические реакции
Местные анестетики и их метаболиты являются слабыми основаниями и легко преодолевают гематоэнцефалический барьер. Токсический эффект проявляется воздействием на центральную нервную систему (ЦНС), периферическую нервную систему, сердечно-сосудистую систему, кровь [5, 6, 7]. Эти реакции чаще всего возникают при абсолютной передозировке, когда доза препарата превышена, или при относительной передозировке, связанной с нарушением метаболизма лекарственных средств. МА имеют «узкий терапевтический коридор», то есть интервал между максимальной терапевтической и минимальной токсической дозой невелик. Токсические реакции могут развиваться и при заболеваниях печени, почек.
Интенсивность токсических реакций разделяют по степени тяжести [6]. Легкие токсические реакции проявляются угнетением ЦНС, заторможенностью, головокружением, сонливостью, тошнотой, тахикардией, колебаниями артериального давления. Выраженные токсические реакции проявляются повышением рефлекторной возбудимости, двигательным беспокойством, рвотой, появлением нистагма, дрожи, зрительных и слуховых нарушений, выраженной артериальной гипотонией, брадикардией, брадиаритмией. При тяжелых токсических реакциях возможно нарушение сердечного ритма, приступы стенокардии, тонические, клонические судороги, паралич дыхательного и сосудодвигательного центров, остановка сердца.
МА подавляют корковые тормозящие пути, результатом чего является бесконтрольная активность возбуждающего компонента. Стадия несбалансированного возбуждения при дальнейшем повышении уровня препарата может перейти в генерализованное торможение ЦНС. При аппликации слишком больших доз МА могут оказывать токсическое действие на ткань нерва. Действие МА на сердечно-сосудистую систему связано как с прямым действием на миокард, так и с непрямым эффектом на вегетативные нервные окончания. Обычно сердечно-сосудистые осложнения развиваются после появления неврологической симптоматики. Все МА, кроме кокаина, уменьшают силу сердечных сокращений, вызывают расширение сосудов, что приводит к артериальной гипотонии. Коллапс чаще развивается при использовании высоких доз анестетика, но иногда и при применении сравнительно малых доз препаратов для инфильтрационной анестезии.
Известно, что введение больших доз прилокаина может привести к кумуляции метаболита, который способен превращать гемоглобин в метгемоглобин. Высокие уровни метгемоглобина переносимы для здоровых людей, но могут вызвать декомпенсацию состояния у пациентов с заболеваниями сердца, легких [7, 8 ,9].
Неаллергическая гиперчувствительность (ферментопатия)
Недостаток ферментов, принимающих участие в метаболизме препаратов, или неполная их активация может привести к развитию побочных реакций. Недостаточная активность псевдохолинэстеразы может нарушить метаболизм эфирных МА.
Аллергические реакции
Истинные аллергические реакции на МА, в формировании которых принимают участие иммунологические механизмы, развиваются достаточно редко и составляют около 1% среди всех побочных реакций на эту группу ЛС. Реакции немедленного типа, IgE-опосредованные, могут проявляться крапивницей, ангионевротическим отеком, симптомами аллергического ринита, конъюнктивита, реакциями анафилаксии, тяжелой степенью которых является анафилактический шок. Чаще встречаются контактные реакции в месте применения МА (отек, гиперемия). Известны случаи отстроченных реакций, которые могут возникать через несколько часов после введения препарата и проявляются в виде различных экзантем, эритродермии, узловатой эритемы, в редких случаях – в виде аллергического васкулита [10, 11, 12].
Псевдоаллергические реакции
Реакции неаллергической гиперчувствительности характеризуются тем, что они опосредованы теми же медиаторами, что и истинная аллергия, клинические проявления имитируют аллергию, но в их формировании иммунологические механизмы не участвуют. Механизм таких реакций может быть связан с прямым неспецифическим высвобождением гистамина из базофилов и тучных клеток или активацией системы комплемента по альтернативному пути. Клинически псевдоаллергические реакции могут проявляться различными экзантемами, анафилактоидным шоком, гиперемией кожи, генерализованным зудом, острым ринитом, бронхоспазмом, нарушением функций желудочно-кишечного тракта. Тяжесть таких реакций зависит от скорости введения МА, его концентрации, способа введения, а также содержания тучных клеток в месте введения препарата. Развитие же истинных аллергических реакций от этих факторов не зависит.
Группы риска возникновения побочных реакций на местные анестетики
Существуют группы лиц, риск возникновения побочных реакций у которых повышен. Это касается любых побочных реакций на МА [12, 13]. К группе риска по развитию побочных реакций на применение МА относятся:
- лица, ранее перенесшие реакции на МА;
- пациенты с аллергическим заболеванием (наличие у пациента аллергического заболевания – фактор риска развития анафилаксии);
- пациенты с ишемической болезнью сердца (ИБС), нестабильной стенокардией, получающие терапию бета-адреноблокаторами;
- пациенты с предполагаемым введением большого объема МА;
- пациенты, у которых МА применяют часто, через короткие интервалы времени, что бывает при санации полости рта, протезировании и др.;
- беременные и кормящие;
- пациенты с выраженной реакцией страха перед процедурой;
- пожилые пациенты.
У пожилых пациентов развитие побочных реакций может быть связано с уменьшением размера тела, объема воды, мышечной массы. У таких больных уменьшается объем распределения ЛС. С возрастом снижается скорость клубочковой фильтрации, функция почечных канальцев (к 65 годам приблизительно на 30%), замедляется кровоток в жизненно важных органах, уменьшается связывающая способность плазмы крови, страдает метаболизирующая функция печени. Сопутствующие заболевания могут приводить к нарушению метаболизма и экскреции ЛС. Гипоальбуминемия приводит к снижению связывания лекарств с белками и повышению свободной активной фракции препарата [14].
Роль вазоконстрикторов, консервантов и стабилизаторов в развитии побочных реакций при применении местных анестетиков
Многие МА вызывают вазодилатацию и поэтому быстро всасываются из зоны инъекции. Для повышения мощности и увеличения продолжительности действия к МА часто добавляют вазоконстрикторы, которые уменьшают системную токсичность анестетиков и увеличивают их терапевтический индекс за счет замедления всасывания. Для блокады проведения импульсов по нервным волокнам достаточно лишь одного МА, однако для пролонгирования его действия и усиления эффекта используют такие вазоконстрикторы, как Адреналин (эпинефрин), Норадреналин (норэпинефрин), Мезатон (фенилэфрин), Октапрессин (фелипрессин). Вазоконстриктор необходим для сокращения сосудов, замедления всасывания местного анестетика, создания высокой концентрации последнего в месте введения. Это усиливает эффект анестезии и уменьшает токсическое действие [5, 6, 7].
Адреналин – самый сильный вазоконстриктор. Он может оказывать нежелательное воздействие на адренорецепторы сердца (тахикардия), сосудов (выраженная вазоконстрикция), печени, вызывать повышение уровня сахара в крови, способствовать сокращению мышц матки. Опасным может быть возможное повышение внутриглазного давления при узкоугольной форме глаукомы, декомпенсация сердечной деятельности у пациентов с сердечно-сосудистыми заболеваниями. Некоторые растворы МА, применяемые в стоматологической практике, содержат вазоконстриктор фелипрессин. Этот некатехоламиновый вазоконстриктор по своему химическому строению напоминает вазопрессин – гормон задней доли гипофиза. Фелипрессин влияет исключительно на периферические кровеносные сосуды, не оказывает воздействия на сердце. Его можно применять у пациентов с ИБС и другими заболеваниями, при которых противопоказано использование катехоламина.
Существуют формы местных анестетиков без содержания вазоконстрикторов. Сведения о содержании вазоконстриктора, его концентрации важны при выборе препарата для анестезии в группах риска.
К группе риска по развитию побочных реакций на вазоконстриктор относятся:
- пациенты с сердечно-сосудистыми заболеваниями (гипертоническая болезнь, ишемическая болезнь сердца, сердечная недостаточность);
- беременные (опасность спазма мускулатуры матки);
- пожилые пациенты (сопутствующие заболевания и базисная терапия многих из них);
- пациенты, получающие лечение глюкокортикостероидами (высокие дозы, длительный прием которых может влиять на состояние надпочечников), трициклическими антидепрессантами, ингибиторами моноаминоксидазы, препаратами с альфа-адреноблокирующей активностью, препаратами раувольфии, тиреотропными гормонами (у этих лиц возможна высокая чувствительность к адреналину) [15].
Консервант (парагидроксибензоат), входящий в состав МА, служит для увеличения срока хранения препаратов. Присутствие этого компонента в препарате также требует анализа его переносимости [6, 12, 13]. Парагидроксибензоаты входят в состав различных косметических препаратов, кремов, зубных паст и могут быть причиной контактных аллергических реакций. Родственное химическое соединение – парааминобензойная кислота – является метаболитом Новокаина, то есть у лиц, имеющих аллергию к эфирным МА, вероятно развитие аллергической реакции на консерванты – эфиры парагидроксибензойной кислоты. Существует опасность развития аллергических реакций на консерванты и у лиц с аллергией к препаратам, имеющим парааминогруппу и бензолсульфонамидную группу.
Стабилизаторы (дисульфит натрия или калия) добавляют в растворы, содержащие адреналин, чтобы предотвратить окисление и повысить стабильность вазоконстриктора [5, 7, 13]. Они могут быть причиной нежелательных реакций при повышенной чувствительности к сульфитам и развития бронхоспазма у больных бронхиальной астмой.
Таким образом, для принятия решения об использовании конкретного местноанестезирующего средства необходимы сведения о самом препарате, о соматическом статусе больного и обо всех применяемых им ЛС, в том числе топического действия.
Принципы подбора местного анестетика в группах риска
У больных ИБС применение катехоламинов может усилить гипоксию миокарда, поэтому используют МА без вазоконстрикторов или в минимальной дозе последних, препарат вводят медленно.
У больных сахарным диабетом применяют МА без катехоламинов или в качестве вазоконстриктора используют фелипрессин.
При заболеваниях почек рекомендуются наименее токсичные МА и с быстрым метаболизмом.
При заболеваниях печени с нарушением ее функции не следует назначать МА, которые метаболизируются в печени, так как из-за снижения кровотока, гипопротеинемии повышается токсичность МА. Для таких пациентов предпочтительнее эфирные анестетики, которые не метаболизируются в печени.
У беременных и кормящих используют наименее токсичные МА, короткого действия.
При глаукоме применяют МА без вазоконстрикторов; в качестве вазоконстриктора возможно использование фелипрессина.
У пожилых пациентов для местной анестезии используют препараты без катехоламинов или с минимальной концентрацией последних [12, 13, 15].
Пациенты с аллергическими заболеваниями – это особая группа лиц. Для решения вопроса о применении МА у этих больных особенно важен подробный аллергологический и фармакологический анамнез. Необходимы сведения о сопутствующих заболеваниях и их базисной терапии. Следует учесть переносимость как самого МА, так и содержащихся в растворе вазоконстриктора, консерванта и стабилизатора. У пациентов с непереносимостью сульфаниламидов не следует использовать эфирные МА. Больным бронхиальной астмой опасно применять МА, содержащие стабилизаторы (дисульфиты натрия и калия), из-за опасности развития бронхоспазма. Сведения о предшествующих реакциях на ЛС других групп помогут избежать развития перекрестных аллергических реакций. Предпочтительнее (с учетом анамнеза) назначать МА группы амидов без содержания стабилизаторов и консервантов. Таким больным особенно опасно превышать дозу! Пациент должен иметь «Паспорт больного аллергическим заболеванием».
Профилактика побочных реакций на местные анестетики
1. Необходимо сопоставить риск возможных осложнений с отрицательными последствиями отказа от применения МА.
2. Следует уточнить переносимость местной анестезии, если она проводилась ранее.
3. Если в прошлом наблюдалась аллергическая реакция на МА, следует использовать препарат, относящийся к другой группе. Так, если «подозреваемое» ЛС относится к производным эфиров, можно применять препараты амидной группы. В случае реакции на МА, содержащие амидную группу, возможно использование другого амидного соединения (предполагают возможность развития перекрестных реакций между лидокаином, прилокаином и мепивакаином) [13].
4. В случае тяжелых предшествующих реакций (как аллергических, так и неаллергических) необходимо отказаться от использования МА.
5. Необходимо определить степень риска не только самого оперативного вмешательства, но и применения местной анестезии.
6. Не использовать препараты, переносимость которых вызывает сомнение.
7. Проведение премедикации по показаниям.
Премедикация
Перед оперативным вмешательством у больных аллергическими заболеваниями в фазе обострения парентерально вводят антигистаминные препараты (хлоропирамин или клемастин) и глюкокортикостероиды (преднизолон, дексаметазон). Доза препаратов, кратность их введения зависят от состояния больного, сопутствующих заболеваний и базисной терапии, применяемой пациентом [4].
Лицам с выраженными реакциями страха (эти лица входят в группу риска) перед манипуляцией рекомендуют прием седативных средств [13].
Когда возникает необходимость проведения диагностических тестов с местными анестетиками?
Не всегда удается выяснить, какой именно МА ранее вызывал реакцию. В ряде случаев не представляется возможным определить только на основании анамнеза характер реакции (аллергическая, псевдоаллергическая, токсическая). К большому сожалению, до сих пор не существует лабораторных тестов, результатам которых можно было бы доверять на 100%. В некоторых случаях проводят определение специфических IgE-антител к некоторым МА. Но эти тесты информативны только при аллергических реакциях немедленного типа, IgE-опосредованных. Наличие специфических Ig, относящихся к другим классам, слабо коррелирует с клиническими проявлениями и не считается достоверным признаком аллергии. В ГНЦ «Институт иммунологии ФМБА России» разработан и успешно применяется тест торможения естественной эмиграции лейкоцитов in vivo по А.Д. Адо, в том числе и с МА. Лабораторные тесты, которые широко применяются в настоящее время, дают большой процент ложноположительных результатов. Некоторые методики трудоемки, дорогостоящи, требуют наличия хорошо оснащенной иммунологической лаборатории, что затрудняет их использование для рутинного обследования. Не существует достоверных тестов, которые бы могли выявить возможность развития псевдоаллергической реакции. В редких случаях необходим подбор конкретного препарата, а именно если:
- ранее при использовании МА у пациента возникали какие-либо побочные явления, механизм которых не ясен;
- отсутствуют медицинские документы с описанием клинических симптомов реакций, возникавших ранее;
- не известны мероприятия, которые проводились для купирования возникшей реакции;
- отсутствуют сведения о препаратах, которыми проводилась анестезия, и о том, получал ли пациент в этот период времени какую-либо сопутствующую терапию для лечения других заболеваний [3].
И еще несколько правил, которым нужно следовать при подборе препарата для местной анестезии.
- Кожные и провокационные тесты с МА проводят только по строгим показаниям, но не используют для удовлетворения любопытства врача или пациента!
- Никакие тесты не проводят с препаратом, вызывавшим реакции ранее. Для проб выбирают МА другой группы.
- Диагностические тесты проводит только врач-аллерголог. Подбор препарата проводится непосредственно перед применением МА. Обследование проводят в процедурном кабинете. Должен иметься противошоковый набор!
- Перед проведением процедуры подбора препарата больной подписывает информированное согласие.
- Пациент на момент обследования не должен применять антигистаминные препараты (отмена препарата за 5–7 дней).
- Необходимое условие – МА не должен содержать вазоконстриктора, консерванта и стабилизатора.
- МА не должен обладать перекрестной реактивностью с препаратом, который ранее вызывал реакцию.
Выдерживая 15-минутные интервалы, проводят тест уколом или скарификационный тест с неразведенным МА (обязательна оценка реакции на тест-контроль и гистамин). Если получена отрицательная реакция, то подкожно вводят 0,1 мл препарата, разведенного 1:100, при отсутствии реакции следующая доза МА 0,1 мл в разведении 1:10. Затем вводят 0,1 мл неразведенного препарата, а при отсутствии реакции пациент получает дозу 1,0 мл и 2,0 мл с пятнадцатиминутными интервалами [3].
Результаты тестов оценивают сразу, в заключении делают уточнение, что в настоящее время аллергии к данному препарату не выявлено, всегда указывается общая доза МА, введенная больному. В течение часа пациент должен оставаться под наблюдением врача [3].
После подбора препарата до момента его использования не должно быть большого интервала времени. Зная особенности формирования лекарственной аллергии, нельзя исключить возможности сенсибилизации за длительный временной период.
Бывает ли поливалентная непереносимость МА? Бывает, но крайне редко и чаще всего неаллергического генеза. Таким пациентам местную анестезию стараются не применять, а в случае необходимости проводят общее обезболивание.
Заключение
Таким образом, перед проведением оперативного или иного вмешательства с применением местного анестетика врач должен не только оценить объем операции, ее риск для пациента, но и ответить на вопросы:
1. Какой МА можно использовать у данного пациента? Необходимо учесть токсичность, длительность действия, химическую группу, к которой относится препарат.
2. Возможно ли использование МА с вазоконстриктором? Если возможно, то с каким вазоконстриктором (катехоламином или фелипрессином) и в какой дозе?
3. Содержит ли данный МА консерванты и стабилизаторы и можно ли использовать их у данного пациента?
4. Необходима ли данному больному консультация аллерголога? Если консультация необходима, то какие вопросы ему следует задать?
5. Нужна ли пациенту премедикация? Введение каких препаратов необходимо и в какой дозе?
Очень часто тщательный анализ ответов на перечисленные выше вопросы помогает избежать осложнений.
Невозможно себе представить современную стоматологию без местной анестезии. Большинство терапевтических, некоторые ортопедические и практически все хирургические вмешательства проводятся после предварительного обезболивания. Широко используемые, заслуженно считающиеся наиболее эффективными и безопасными артикаинсодержащие местные анестетики позволяют при корректном соблюдении правил их применения избегать многих осложнений [3]. Но еще используют лидокаин и даже прокаин (новокаин), а в челюстно-лицевой хирургии — ропивакаин с целью длительного интра- и послеоперационного обезболивания, поэтому врачи должны хорошо понимать, насколько велик риск осложнений, непосредственно связанный с применением местных анестетиков (см. схему).
Остановимся на системных токсических реакциях на местные анестетики — одном из малоизученных осложнений, которое может привести к критическому исходу. В отличие от аллергических реакций системные токсические реакции на местные анестетики встречаются нередко, особенно при использовании высоких доз препаратов. За последние десятилетия учеными всего мира была проведена большая исследовательская и аналитическая работа по изучению токсического действия местных анестетиков на организм человека и определению ведущих признаков, отличающих это осложнение от аллергических реакций. Опубликованные результаты статистических исследований убедительно свидетельствуют о том, что современные местноанестезирующие препараты значительно менее опасны как аллергены (риск возникновения аллергии — 1:2 000 000 инъекций) и гораздо чаще вызывают системные токсические реакции (риск оценен как 1:1000 инъекций) [12].
Системные токсические реакции на местные анестетики в челюстно-лицевой хирургии и стоматологической практике, в отличие от общей хирургии, где эти препараты с целью региональной анестезии вводятся в значительно большем количестве, встречаются реже, но об этом осложнении необходимо помнить из-за вероятности их трагического исхода.
Современный рынок предоставляет стоматологам широкий выбор местных анестетиков. Важно при определении наиболее безопасного препарата ориентироваться прежде всего на его анестетический индекс, продолжительность эффективного действия и сочетаемость с другими препаратами, принимаемыми пациентом. В табл. 1 представлена информация о максимальных дозах, времени действия, активности и токсичности местных анестетиков.
Таблица 1. Анестезирующая активность, продолжительность действия, токсичность и максимально допустимая доза различных местных анестетиков Примечание. м/а — местный анестетик; м/а+в/к — местный анестетик с вазоконстриктором; активность — отношение минимальной действующей дозы новокаина к минимальной действующей дозе другого препарата; токсичность — отношение минимальной летальной дозы новокаина к минимальной летальной дозе другого препарата; анестетический индекс — отношение силы действия препарата к относительной токсичности препарата.
Обезболивающий эффект местного анестетика определяют его вазоактивность, жирорастворимость, способность связываться с протеинами и кислотность. Определенные коррективы, конечно, вносят соматический статус пациентов, а также происходящие в случае базисной лекарственной терапии фармакологические взаимодействия.
Скорость наступления анальгетического эффекта, системную абсорбцию, метаболизм и элиминацию местного анестетика определяют его физико-химические свойства. Так, жирорастворимость и протеинсвязывающая характеристики местного анестетика зависят от его тропности к клеточной оболочке нейрона, которая состоит из жира (90%) и протеина (10%). Чем выше жирорастворимость препарата, тем легче он проникает через оболочку, следовательно более эффективен. Чем лучше анестетик связывается с протеином, тем больше продолжительность его действия. Константа диссоциации препарата определяет скорость наступления анальгетического эффекта, а также абсорбции и элиминации.
После инъекции часть анестетика диффундирует на мембрану нейрона; оставшийся препарат попадает в сосудистое русло. Повышенная абсорбция местного анестетика приравнивается к прямому попаданию в сосуд; особенно этого следует опасаться в условиях кислой среды воспалительного очага. Количество абсорбированного сосудами препарата зависит от васкуляризации и величины кровотока в анестезированной ткани, а также влияния местного анестетика на тонус сосудистой стенки. При инфильтрационной анестезии амидные анестетики среднего и длительного действия вызывают вазодилатацию, а ропивакаин (наропин) в отличие от других длительно действующих препаратов (бупивакаин гидрохлорид — маркаин), дает сосудосуживающий эффект. Если в местноанестезирующем препарате содержится вазоконстриктор, скорость системной абсорбции замедляется, но появляется риск развития тахикардии и мерцательной аритмии.
До недавнего времени считалось, что степень проявления системной токсической реакции строго зависит от концентрации и количества вводимого анестетика. Так, на примере лидокаина (рис. 1) были показаны пиковые уровни концентрации анестетика в плазме крови, определяющие возможную клиническую картину системной токсической реакции.
Рис. 1. Зависимость клинических проявлений системной токсической реакции лидокаина от уровня его плазменной концентрации.
Однако, по данным публикаций последних лет, описанные случаи системной токсичности местных анестетиков в практике общей и челюстно-лицевой хирургии позволили предположить, что проявление токсических реакций не всегда зависит от излишнего количества введенного анестетика; даже рекомендуемые к применению дозы препаратов могут вызвать это осложнение [6, 16, 18].
Клинически системное токсическое действие местных анестетиков чаще проявляется симптомами повреждения ЦНС и реже — кардиоваскулярной. В связи с разнообразием условий, определяющих сроки и скорость поступления местноанестезирующего препарата в сосудистое русло, период развития клинической симптоматики системной токсичности колеблется в достаточно широких пределах — от 1—5 до >60 мин [10].
По тяжести клинических симптомов в системной токсичности местных анестетиков выделяют 3 степени [2]. При легкой ее степени (малые токсические реакции) первые жалобы пациента — на покалывание и зуд в области введения анестетика; эти ощущения могут распространяться на губы и язык. Одновременно появляются шум в ушах и металлический привкус во рту. Дыхание и гемодинамика не нарушены, может отмечаться умеренная тахикардия. Поскольку сознание пациента сохранено, изменения в самочувствии, как правило, не остаются незамеченными; они вызывают у пациента определенное беспокойство, нарастающее по мере усиления симптоматики; нередко присоединяется чувство страха. Клиническая картина развития токсической реакции может ограничиваться этим, постепенно неприятные ощущения проходят без дополнительных лечебных мероприятий, пациент успокаивается. Чаще всего легкие осложнения местной анестезии остаются не замеченными врачом и не фиксируются в истории болезни. Но если к субъективным ощущениям пациента присоединяются дрожь, подергивания отдельных мышц, тошнота, возможно, и рвота, отмечаются признаки нарушения сознания, в частности ориентации, следует понимать, что токсическая реакция развивается и переходит уже в среднюю степень тяжести. При максимальной выраженности клинических проявлений в этой стадии сознание пациента становится спутанным, речь нарушена, характерны оцепенение и заторможенность, отмечаются учащенное дыхание, снижение артериального давления, брадикардия, двигательное возбуждение или судороги. Появление судорог свидетельствует о том, что системная токсическая реакция переходит в тяжелую степень. На фоне судорог могут произойти потеря сознания, снижение мышечного тонуса, нарушение дыхания вплоть до апноэ, аритмии, асистолия, расслабление и паралич сфинктеров. Без оказания пациентам в критическом состоянии экстренной помощи, включающей в себя реанимационные мероприятия с обязательными специфическими элементами, неизбежен летальный исход.
Системная токсическая реакция на местные анестетики клинически не обязательно проявляется всеми перечисленными признаками, нередко наблюдаются отдельные из них. Анализ 93 случаев системной токсичности местных анестетиков показал, что классическая клиническая картина развивалась только у 60% пострадавших; преобладание патологических признаков со стороны ЦНС с кардиоваскулярными нарушениями наблюдается в 30,3% случаев, и только изолированные сердечно-сосудистые нарушения описаны у 9,7% пациентов [10].
Частота клинических признаков, свидетельствующих о развитии системной токсической реакции при случайном внутрисосудистом введении местного анестетика, представлена на рис. 2.
Рис. 2. Частота развития клинических признаков токсического действия местных анестетиков [7].
Из-за сложности проведения исследований (на человеке их выполнить невозможно!) до конца механизм развития системной токсичности остается непонятным. На сегодня известно, что местные анестетики тормозят процесс окислительного фосфорилирования, поэтому наиболее тяжелые нарушения происходят в органах, хуже всего приспособленных к анаэробному метаболизму дыхания, а это прежде всего головной мозг и сердце [2].
Считается, что токсическое влияние на клетки головного мозга определяет способность местного анестетика проникать через гематоэнцефалический барьер и блокировать натриевые каналы возбудимых клеточных мембран, что вызывает разные по тяжести токсические реакции. Если появляется судорожный синдром, сопровождающий его метаболический ацидоз повышает захват препарата не только нейронами головного мозга, но и кар-диомиоцитами.
Кардиотоксичность, вероятно, прежде всего определяется способностью местных анестетиков обратимо связываться с внутриклеточной частью потенциалзависимых натриевых каналов кардиомиоцита, препятствуя их открытию и тем самым предотвращая генерацию потенциала действия и его распространение вдоль нервного волокна. И чем выше эта способность анестетика, тем сильнее его обезболивающий эффект, но вместе с тем — и тормозящее влияние на проводящую систему сердца [8].
Все местные анестетики в высоких концентрациях увеличивают рефрактерный период сердца, угнетают возбудимость, сократимость и проводимость миокарда — значит, в превышающих допустимые концентрации дозах любой из местноанестезирующих препаратов может вызвать тяжелую депрессию миокарда. Важно отметить, что клиническая картина системной токсичности, вызванная лидокаином, проявляется прежде всего выраженными патологическими реакциями со стороны ЦНС; это позволяет врачу вовремя принять необходимые меры по спасению пациента. А более мощные по сравнению с лидокаином препараты даже в считающейся допустимой плазменной концентрации могут, не вызывая конвульсивных проявлений и не снижая сократительной способности миокарда, спровоцировать различные по тяжести аритмии [8].
Особая осторожность при проведении местной анестезии требуется пациентам с факторами риска по системной токсичности; к ним относят анемию; гипопротеинемию; хроническую сердечную недостаточность с застойными явлениями; нарушение функции печени и почек; эндокринные и обменные заболевания; беременность; пожилой возраст и ранний возраст (дети). По сравнению со взрослыми у детей раннего возраста значительно выше отношение сердечного выброса и регионарного кровотока к массе тела, и системные токсические реакции у детей развиваются быстрее в связи с быстрым нарастанием пиковых токсических концентраций препарата в плазме. Так, у ребенка 3 лет после аппликационной анестезии происходит почти мгновенная абсорбция местного анестетика, а время наступления пиковой плазменной концентрации лидокаина при проведении инфильтрационной анестезии сравнимо с таковым при его внутривенном введении.
Отдельно следует остановиться на лечении пациентов под седацией и общей анестезией с использованием местных анестетиков. В литературе [10] описаны 2 случая системной токсичности у младенцев 6 и 9 мес во время проведения уранопластики под общей анестезией через несколько минут после инфильтрации местного анестетика (в одном случае — лидокаина, в другом — артикаина). Проявившийся судорожный синдром не оставил сомнений в диагнозе, и помощь была оказана своевременно. По завершении послеоперационной реабилитации пациентов выписали из стационара без неврологического дефицита. Анализ других эпизодов системной токсичности, возникших во время общей анестезии, показывает, что чаще проявляются признаки осложнения со стороны сердечно-сосудистой системы, поскольку ЦНС блокирована, и ранние симптомы остаются незамеченными.
Профилактика токсического действия местных анестетиков
Системную токсическую реакцию можно предвидеть в случаях планируемого лечения пациентов группы риска, при превышении рекомендуемой дозы анестетиков, несоблюдении методики проведения анестезии. Но, к сожалению, не существует гарантирующего варианта предупреждения этого осложнения [15].
Профилактика системной токсичности заключается в строгом соблюдении инструкций по применению местных анестетиков, безошибочном выполнении техники анестезии и внимательном отношении к пациенту как на этапе подготовки к лечению, так и во время его проведения.
При первичной консультации обязательно выясняйте полную информацию о здоровье пациента. При наличии сопутствующих соматических заболеваний получите выписку из истории болезни с указанием диагноза и рекомендованной к применению базисной терапии. В случае необходимости проведите дополнительное обследование. Перед лечением обязательно определите физическое состояние больного и зафиксируйте в истории болезни основные параметры (цифры артериального давления, частоты сердечных сокращений, частоты дыхания). Обязательно проинформируйте пациента о возможных рисках и получите его письменное согласие на проведение всех запланированных вмешательств [3].
При выборе местноанестезирующего препарата обязательно предпочтите наименее токсичные из них, если это позволяет ситуация. Использование местных анестетиков длительного действия оправдано при длительных вмешательствах, требующих пролонгированного после-операционного обезболивания, и только при наличии полного набора реанимационного оборудования.
Обязательно используйте минимально эффективную дозу местного анестетика, выбирайте достаточную его концентрацию и не превышайте необходимый объем анестетика. Учитывайте абсорбционные способности окружающих тканей в месте проведения инъекции [4].
Перед введением анестетика обязательно проводите аспирационную пробу и повторяйте ее, если перемещаете иглу по ходу введения; не забывайте, что результаты аспирационной пробы бывают ложноотрицательными примерно в 2% случаев. Для повышения безопасности при возможности используйте ультразвуковую навигацию во время проведения инъекции, хотя ее эффективность еще мало изучена и риск внутрисосудистого введения анестетика остается [5].
Обязательно вводите местный анестетик постепенно, медленно (1 мл/мин) или дробно с паузами в 15—30 с. При введении больших порций анестетика интервал введения необходимо увеличивать для снижения кумуляции [4].
Не прерывайте вербальный контакт с пациентом во время проведения местной анестезии; обязательно наблюдайте за его реакцией во время манипуляции и активно выявляйте жалобы — это повышает вероятность того, что первые субъективные признаки развивающейся системной токсической реакции будут замечены вами вовремя [3].
Ниже представлены максимально допустимые дозы наиболее употребляемых в амбулаторной стоматологической практике местных анестетиков для детей и взрослых (табл. 2—5).
Таблица 2. Максимально допустимые дозы лидокаина 2%
Таблица 3. Максимально допустимые дозы мепивакаина 2%
Таблица 4. Максимально допустимые дозы артикаина 4%
Таблица 5. Максимально допустимые дозы мепивакаина 3%
Лечебные мероприятия при системной токсической реакции
До недавнего времени лечение системных токсических нарушений, вызванных местными анестетиками, предусматривало использование противосудорожных препаратов, обеспечение адекватной оксигенации пациента вплоть до интубации трахеи с последующим проведением искусственной вентиляции легких, инфузионную терапию большими объемами кровезаменителей с введением глюкокортикостероидов и препаратов, корригирующих кардиоваскулярные нарушения. Проведение при необходимости сердечно-легочно-церебральной реанимации не предусматривало никаких особенностей, комплекс выполнялся по общему протоколу [1].
В настоящее время наряду с мероприятиями по замещению витальных функций пациента приоритет в лечении системной токсичности принадлежит снижению, а по возможности — устранению системного действия местных анестетиков [13]. Рекомендованное внутривенное введение липидных растворов, эффективность которых доказана экспериментально и клинически [9], позволяет купировать симптомы токсичности за счет связывания липофильных местных анестетиков. Плазменная концентрация препаратов снижается, происходит их «вымывание» (отсоединение по градиенту концентрации от мембраны нейрона и кардиомиоцита) и выведение с новыми порциями липида. Кроме того, известно, что содержащие липиды растворы являются энергетическим субстратом для митохондрий сердца и эта их способность оказывается востребованной в случае кардиотоксических реакций. Лечебная схема с использованием для устранения системных токсических реакций местных анестетиков раствора интралипида (20%) была названа «липидным спасением» [7].
Клиническая картина тяжелой стадии системной токсичности местных анестетиков может развиваться стремительно, поэтому очень важно правильно оценить первые симптомы и вовремя приступить к оказанию экстренной помощи. Судорожный синдром по-прежнему является абсолютным показанием к применению бензодиазепинов; опаснее купировать его пропофолом или барбитуратами ультракороткого действия из-за их собственного выраженного кардиодепрессивного действия. Как и в прежних рекомендациях, одним из первых мер по спасению пациента является обеспечение его адекватной оксигенации любым доступным способом, включая интубацию трахеи и аппаратную искусственную вентиляцию легких 100% кислородом. В случае неэффективного кровообращения на фоне аритмии или асистолии незамедлительно следует приступить к проведению реанимационных мероприятий и продолжать их не менее 60 мин. Поскольку местные анестетики не вызывают необратимых изменений миокарда, при достаточной оксигенации головного мозга и введении липидных растворов в течение этого времени остается надежда на спасение пациента. Крайне важно не спешить прекращать эффективные реанимационные мероприятия, если системная токсичность вызвана мощными анестетиками, потому что на их «вымывание» требуется длительный период времени [6]. При проведении в случае необходимости симптоматической терапии нужно избегать введения липофильных препаратов — β-блокаторов и блокаторов кальциевых каналов, отказаться от вазопрессина, для купирования желудочковых аритмий использовать только амиодарон (кордарон), снизить дозировку эпинефрина (адреналина) до менее чем 0,1 мкг/кг или полностью отказаться от его введения [13].
Источники литературы [20] сообщают о том, что при системной токсической реакции на местные анестетики быстрое введение больших объемов липидных растворов не сопровождается значительными осложнениями, а их клиническая эффективность на фоне реанимационных мероприятий позволяет избежать остаточных кардиологических нарушений и неврологического дефицита [10, 17].
Для «липидного вымывания» можно использовать любую жировую эмульсию, но лучше всего себя зарекомендовал интралипид (20%) [11]. Не следует проводить инактивацию местных анестетиков диприваном (пропофолом) из-за необходимости для получения положительного результата большого количества препарата в связи с низким содержанием в нем липидов, а это опасно, поскольку диприван дает прямой кардиодепрессивный эффект [15]. Сегодня купирование системной токсической реакции на местные анестетики рекомендовано проводить липидами, начиная введение препарата при появлении первых характерных жалоб или симптомов и одновременно быть готовым к выполнению полного комплекса реанимационных мероприятий [6].
В каждом лечебном учреждении, в том числе стоматологическом, где используются местные анестетики, необходимо иметь 1 л раствора жировой эмульсии (интралипид 20% — 500 мл или иной), шприцы для проведения «липидного вымывания» объемом 50 мл, периферические внутривенные катетеры 14—16 G, системы для инфузии, копию протокола «липидное спасение» («LipidRescue») [19].
После катетеризации периферической вены начинать вводить липидный раствор необходимо болюсно (интралипид 20% — 1,5 мл/кг) при помощи шприцев 50 мл, затем перейти на капельную инфузию (интралипид 20%, скорость — 0,25 мл/кг/мин) и продолжать введение препарата в таком темпе не менее 10 минут уже после стабилизации кровообращения. Если этой дозой липидного раствора стабилизировать кровообращение не удается, необходимо повторить его болюсное введение в той же дозировке (интралипид 20% — 1,5 мл/кг) и перейти на ускоренную инфузию препарата (интралипид 20%, скорость — 0,5 мл/кг/мин). Допустима высшая разовая доза жировой эмульсии — 10 мл/кг/мин.
На форуме «Euroаnaesthesiа-2010» в Хельсинки (Финляндия) Европейским советом по анестезиологии (European Board of Anaesthesiology) совместно с Европейским обществом анестезиологии (European Society of Anaesthesiology) была принята декларация по безопасности пациентов в анестезиологии. В ней предусмотрены основополагающие моменты, позволяющие предупреждать и избегать серьезных осложнений, предотвращать опасность для пациентов. В частности, указано, что все лечебные учреждения, в которых используются местные анестетики «…должны иметь протоколы и средства, необходимые в ситуации системной токсичности…» [14]. Хельсинкская декларация была одобрена Всемирной организацией здравоохранения (World Health Organization), Всемирной федерацией обществ анестезиологов (World Federation of Societies of Anaesthesiologists) и Федерацией пациентов Европы (European Patients Federation). С учетом особенностей каждая страна вправе доработать и адаптировать к своим условиям протокол проведения реанимации с использованием липидных растворов. Мы считаем эту задачу крайне важной для нашего врачебного сообщества.
Авторы заявляют об отсутствии конфликта интересов.
Риски и осложнения
Местная анестезия обычно считается очень безопасной. Для небольших операций это безопаснее, чем при общей анестезии.
При приеме препарата и при его истощении могут наблюдаться покалывание и боль, а также могут быть синяки, но обычно они незначительны.
Человек, у которого была местная анестезия, должен быть осторожен, чтобы не пораниться, в то время как он не может чувствовать боль, например, кусая щеку после лечения зубов.
Временные побочные эффекты, которые влияют на некоторых людей, включают:
- затуманенное зрение, головокружение и рвота
- головная боль
- подергивание мышц
- постоянное онемение, слабость или покалывание
У некоторых людей может быть аллергическая реакция. У пациента могут появиться крапивница, зуд и затрудненное дыхание.
Может возникнуть цианоз, при котором кожа становится синеватой из-за плохого кровообращения или недостаточной оксигенации крови.
В очень тяжелых случаях человек может испытывать депрессивный синдром ЦНС, при котором центральная нервная система слишком сильно замедляется, что приводит к снижению частоты дыхания и частоты сердечных сокращений. Это может привести к остановке сердца, если кровь перестанет качать к сердцу.
Передозировка местного анестетика может привести к судорогам. Это может быть опасно для жизни.
Механизмы действия и виды анестетиков
Анестетики разделяют на:
- Местные
- Общие: а) ингаляционные — летучие жидкости и газы б) неингаляционные (внутривенные)
Таблица 1
1. Местные анестетики
Местные анестетики обратимо снижают возбудимость чувствительных нервных окончаний и блокируют проведение афферентных импульсов в нервных стволах в зоне непосредственного применения, используются для устранения боли.
Первый препарат этой группы — кокаин, был выделен в 1860 г. Альбертом Ньюманом из листьев южноамериканского кустарника Erythroxylon coca. Ньюман, как многие химики прошлого, попробовал новое вещество на вкус и отметил онемение языка. Профессор Военно-медицинской академии Санкт-Петербурга Василий Константинович Анреп в 1879г. подтвердил способность кокаина вызывать анестезию. В экспериментах на лягушках он обнаружил, что кокаин влияет «парализующим образом» на окончания чувствительных нервов. В. К. Анреп исследовал действие кокаина на себе: инъекция кокаина в дозе 1 — 5 мг под кожу сопровождалась полной анестезией — укол булавкой, прижигание тлеющей спичкой не вызывали боли. Аналогичный эффект наблюдался при закапывании раствора кокаина в глаз и нанесении его на слизистую оболочку языка.
Местные анестетики классифицируют на сложные эфиры (анестезин, дикаин, новокаин) и замещенные амиды (лидокаин, тримекаин, бупивакаин). Местные анестетики — сложные эфиры подвергаются гидролизу псевдохолинэстеразой крови и действуют в течение 30 — 60 мин. Их эффект пролонгируют антихолинэстеразные средства (прозерин). Продукт гидролиза — n-амино-бензойная кислота ослабляет бактериостатическое влияние сульфаниламидов. Замещенные амиды кислот инактивируются монооксигеназной системой печени в течение 2 — 3 ч. Бупивакин вызывает местную анестезию продолжительностью 3 — 6 ч, после ее прекращения длительно сохраняется анальгетический эффект.
С точки зрения практического применения анестетики подразделяют на следующие группы:
- Средства, применяемые для поверхностной (терминальной) анестезии: Кокаин, Дикаин, Анестезин, Пиромекаин
- Средства, применяемые преимущественно для инфильтрационной и проводниковой анестезии: Новокаин, Бупивакаин
- Средства, применяемые для всех видов анестезии: Лидокаин, Тримекаин
Механизм действия
Местные анестетики представляют собой третичные азотистые основания. Они состоят из гидрофильной и липофильной частей, соединенных эфирной или амидной связями. Механизм действия определяет липофильная часть, имеющая ароматическую структуру. Для нанесения на слизистые оболочки и кожу и парентерального введения применяют водные растворы хлористоводородных солей местных анестетиков. В слабощелочной среде тканей (рН=7,4) соли гидролизуются с освобождением оснований. Основания местных анестетиков растворяются в липидах мембран нервных окончаний и стволов, проникают к внутренней поверхности мембраны, где превращаются в ионизированную катионную форму.
Рисунок 1 | Механизм действия местных анестетиков
Рецепторы для местных анестетиков локализованы в S6-сегменте IV домена внутриклеточной части натриевых каналов. Связываясь с рецепторами, катионы местных анестетиков пролонгируют инактивированное состояние натриевых каналов, что задерживает развитие следующего потенциала действия. Местные анестетики не взаимодействуют с закрытыми каналами в период потенциала покоя. Таким образом, в зоне нанесения местных анестетиков не развиваются потенциалы действия, что сопровождается блоком проведения нервных импульсов. Избирательное влияние местных анестетиков на чувствительные афферентные нервы обусловлено генерацией в них длительных (более 5 мс) потенциалов действия с высокой частотой.
В первую очередь местные анестетики блокируют безмиелиновые С и миелиновые Аδ и Аβ волокна (афферентные пути, проводящие болевые и температурные раздражения; вегетативные нервы). На волокна, окруженные миелиновой оболочкой, местные анестетики действуют в области перехватов Ранвье. Толстые миелиновые волокна (афферентные пути, проводящие тактильные раздражения; двигательные нервы) слабее реагируют на местные анестетики. Кроме того, устойчивость двигательных нервов к анестезии обусловлена низкочастотными короткими (менее 5 мс) потенциалами действия. В очаге воспаления в условиях ацидоза нарушаются диссоциация хлористоводородных солей местных анестетиков и образование их свободных липидорастворимых оснований, поэтому обезболивающее влияние утрачивается. Например, местная анестезия может оказаться неэффективной при удалении зуба в случае тяжелого периодонтита.
2. Общие анестетики
2.1. Ингаляционные анестетики
2.1.1 Летучие жидкости
Теории механизма действия общих анестетиков
Эффекты ингаляционных анестетиков не могут быть объяснены одним молекулярным механизмом. Скорее всего многокомпонентное действие каждого анестетика реализуется через множество мишеней. Тем не менее, эти эффекты сходятся на ограниченном числе изменений, лежащих в основе физиологических эффектов. На данный момент существуют липидная и белковая теории анестезии, но ни одна из них пока не описывает последовательность событий, происходящих от взаимодействия молекулы анестетика и ее мишеней до физиологических эффектов.
Рисунок 2 | Ингаляционные анестетики
Активность ингаляционных анестетиков оценивают по минимальной альвеолярной концентрации (МАК). Доза, создающая 1 МАК, предотвращает у половины пациентов движения в ответ на хирургическое вмешательство. Сила общих анестетиков коррелирует с их растворимостью в жирах, что говорит о важности взаимодействия с гидрофильными мишенями. В частности, обнаружение связи между силой анестетика и его липофильностью (правило Мейер-Овертона) дало начало липидной теории механизма действия анестетиков. Липидная теория анестезии утверждает, что анестетики растворяются в двойном липидном слое биологических мембран и вызывают анестезию, достигая критической концентрации в мембране. Наиболее усложненные версии липидной теории требуют, чтобы молекулы анестетиков вызывали пертурбацию (изменение свойств) мембраны.
Рисунок 3 | Правило Мейер-Овертона
Рисунок 4 | В 20 веке было показано, что сила общих анестетиков коррелируют с их способностью ингибировать активность растворимого фермента люциферазы, который физиологически не является мишенью анестетиков, но служит в качестве безлипидной модели белковой молекулы для связывания анестетика.
Современные факты позволяют утверждать, что белки в большей степени, чем липиды, являются молекулярными мишенями для действия анестетиков. Взаимодействие анестетиков с гидрофобными участками белков также объясняет правило Мейер-Овертона. Прямое взаимодействие молекул анестетиков с белками позволяет объяснить исключения из этого правила, так как любые участки связи с белком определяются как размером и формой молекулы, так и растворимостью. Многочисленные физические методы (рентгенодифракция, ЯМР-спектроскопия) подтверждают, что общие анестетики действуют путем непосредственного связывания с амфифильными полостями белковых молекул, а размер связанного участка объясняет эффект «обрубания» свойства (более длинные спирты теряют свойства анестетика).
Механизм действия
Таким образом, общие анестетики изменяют физико-химические свойства липидов мембран нейронов и нарушают взаимодействие липидов с белками ионных каналов. При этом уменьшается транспорт в нейроны ионов натрия, сохраняется выход менее гидратированных ионов калия, в 1,5 раза возрастает проницаемость хлорных каналов, управляемых ГАМК-А рецепторами. Итогом этих эффектов становится гиперполяризация с усилением процессов торможения. Общие анестетики подавляют вход в нейроны ионов кальция, блокируя Н-холинорецепторы и NMDA-рецепторы глутаминовой кислоты; снижают подвижность Са2+ в мембране, поэтому препятствуют кальций-зависимому выделению возбуждающих нейромедиаторов. Наиболее чувствительны к действию общих анестетиков полисинаптические системы ЦНС — кора больших полушарий (1013 – 1014 синапсов), таламус, ретикулярная формация, спинной мозг. К наркозу устойчивы дыхательный и сосудодвигательный центры продолговатого мозга.
Летучие ингаляционные анестетики:
- постсинаптически усиливают тормозящую передачу путем потенциирования лиганд-управляемых ионных каналов, активируемых ГАМК и глицином;
- экстрасинаптиески путем усиления ГАМК-рецепторов и ионных токов утечки;
- пресинаптически за счет повышения базального высвобождения ГАМК.
Ингаляционные анестетики подавляют возбуждающую синаптическую передачу путем снижения высвобождения глутамата и постсинаптически путем ингибирования ионотропных глутаматных рецепторов. Парализующий эффект местных анестетиков включает действие на спинной мозг, в то время как седация/наркоз и амнезия включают супраспинальные механизмы памяти, сна и сознания.
2.1.2. Газовый наркоз
В анестезиологии широко применяют ингаляционный газовый анестетик азота закись (N2O). В конце 1980-х гг. в зарубежную анестезиологическую практику вошел инертный газ ксенон.
Азота закись представляет собой бесцветный газ характерного запаха, хранится в металлических баллонах под давлением 50 атм в жидком состоянии, не горит, но поддерживает горение. Ее смеси с анестетиками группы летучих жидкостей в определенных концентрациях взрывоопасны. В субнаркотических концентрациях (20 — 30 %) азота закись вызывает эйфорию (веселящий газ) и сильную анальгезию. В концентрации 20 % обеспечивает обезболивание в такой же степени, как 15 мг морфина. Закись азота на ГАМК-А рецепторы не влияет. Используется только в комбинациях, так как МАК составляет 104 %.
Инертный газ ксенон считают лучшей альтернативой азота закиси, так как он обладает более выраженным наркозным действием, индифферентностью и экологической безопасностью. Способность ксенона вызвать наркоз была открыта в связи с практикой глубоководных погружений и развитием гипербарической физиологии. Ксенон бесцветен, не горит и не обладает запахом, при соприкосновении со слизистой оболочкой рта создает на языке ощущение горьковатого металлического вкуса. Отличается низкой вязкостью и высокой растворимостью в липидах, выводится легкими в неизмененном виде. Разработана технология ксенонсберегающей анестезии с включением минимального потока и системы рециклинга для повторного многократного использования газа. Такая технология успешно решает важную в практическом отношении проблему дефицита и дороговизны ксенона. В механизме наркозного эффекта ксенона имеют значение блокада циторецепторов возбуждающих нейромедиаторов — Н-холинорецепторов, NMDA-рецепторов глутаминовой кислоты, а также активация рецепторов тормозящего нейромедиатора глицина. При взаимодействии с циторецепторами ксенон выступает как протонсвязывающий кластер и образует комплексы с катионами НСО+, NH2+, HNCH+. Ксенон проявляет свойства антиоксиданта и иммуностимулятора, снижает выделение гидрокортизона и адреналина из надпочечников.
2.2. Неингаляционные (внутривенные) наркозные средства подразделяют на три группы:
Препараты короткого действия (3 — 5 мин)
- пропанидин (эпонтол, сомбревин)
- пропофол (диприван, рекофол)
Препараты средней продолжительности действия (20 — 30 мин)
- кетамин (калипсол, кеталар, кетанест)
- мидазолам (дормикум, флормидал)
- гексенал (гексобарбитал-натрий)
- тиопентал-натрий (пентотал)
Препараты длительного действия (0,5 — 2 ч)
- натрия оксибутират
Рисунок 5 | Общие анестетики для внутривенного введения
Механизм действия
Наиболее широко используемым внутривенный анестетиком является пропофол. Его механизм действия связан с увеличение хлорной проводимости ГАМК рецепторов.
Метогекситал по скорости наступления и выхода из наркоза близок к пропофолу.
Барбитураты использовались для анестезии до введения в практику пропофола. Тиопентал вызывает быстрое наступление и быстрый выход из наркоза при разовом введении, но он быстро накапливается при повторном или пролонгированном введении и таким образом замедляет выход из анестезии. Барбитураты являются лигандами барбитуратных рецепторов. В малых дозах они аллостерически усиливают действие ГАМК на ГАМК А-рецепторы . При этом удлиняется открытое состояние хлорных каналов, возрастает вход в нейроны анионов хлора, развиваются гиперполяризация и торможение. В больших дозах барбитураты прямо повышают хлорную проницаемость мембран нейронов. Кроме того, они тормозят высвобождение возбуждающих медиаторов ЦНС — ацетилхолина и глутаминовой кислоты, блокируют АМРА-рецепторы (квисквалатные рецепторы ) глутаминовой кислоты. Барбитураты обладают церебропротективными свойствами и могут быть использованы с такой целью.
Бензодиазепины используются в основном как анксиолитики и для седации с сохранением сознания.Все бензодиазепиновые рецепторы аллостерически усиливают кооперацию ГАМК с ГАМК А-рецепторами, что сопровождается повышением хлорной проводимости нейронов, развитием гиперполяризации и торможения. Реакция с бензодиазепиновыми рецепторами происходит только в присутствии ГАМК. Ремимазолам — самый молодой бензодиазепин, имеет очень короткое время действия из-за быстрой нейтрализации эстеразами плазмы.
Кетамин химически является производным фенциклидина. Синаптические механизмы действия кетамина многообразны. Он является неконкурентным антагонистом возбуждающих медиаторов головного мозга глутаминовой и аспарагиновой кислот в отношении NMDA-рецепторов. Эти рецепторы активируют натриевые, калиевые и кальциевые каналы мембран нейронов. При блокаде рецепторов нарушается деполяризация. Кроме того, кетамин стимулирует освобождение энкефалинов и β-эндорфина; тормозит нейрональный захват серотонина и норадреналина. Последний эффект проявляется тахикардией, ростом АД и внутричерепного давления. Кетамин расширяет бронхи. При выходе из кетаминового наркоза возможны бред, галлюцинации, двигательное возбуждение (эти нежелательные явления предупреждают введением дроперидола или транквилизаторов).Важным терапевтическим эффектом кетамина является нейропротективный. Как известно, в первые минуты гипоксии мозга происходит выброс возбуждающих медиаторов — глутаминовой и аспарагиновой кислот. Последующая активация NMDA-рецепторов, увеличивая во внутриклеточной среде концентрацию ионов натрия и кальция и осмотическое давление, вызывает набухание и гибель нейронов. Кетамин как антагонист NMDA-рецепторов устраняет перегрузку нейронов ионами и связанный с этим неврологический дефицит.
Самым новым внутривенным анестетиком является дексмедетомидин. Это высокоселективный агонист а2-адренорецепторов с седативными, симпатолитическими, снотворными и анальгетическими эффектами. Его основное действие — в качестве агониста на а2 рецепторы в голубом пятне.
Источники:
- Теории механизма действия — https://en.wikipedia.org/wiki/Theories_of_general_anaesthetic_action и https://www.esus.ru/php/content.php?id=744
- Венгеровский А.И., Лекции по фармакологии для врачей и провизоров 2007
- Харкевич, Фармакология изд. 10
- Miller’s anesthesia / Ronald D. Miller ; associate editors, Neal H. Cohen, Lars I. Eriksson, Lee A. Fleisher, Jeanine P. Wiener-Kronish, William L. Young. — Eighth edition. 2015